
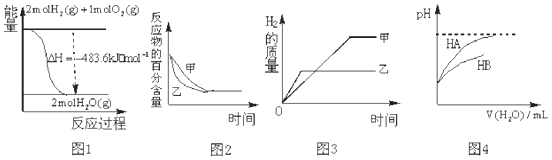
| A. | 图 1 表示 H2与O2发生反应过程中的能量变化,则H2的燃烧热为 241.8kJ•mol-1 | |
| B. | 图 2 表示压强对可逆反应 2A(g)+2B (g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. | 图 3 表示等质量的钾、钠分别与足量水反应,则甲为钠 | |
| D. | 图 4 表示常温下,稀释 HA、HB 两种酸的稀溶液时,溶液 pH 随加水量的变化,则相同条件下 NaA溶液的 pH 大于同浓度的 NaB 溶液的 pH. |
分析 A.燃烧热是1mol可燃物完全反应生成稳定氧化物放出的热量;
B.增大压强,加快化学反应速率,平衡向着气体体积减小的方向移动;
C.金属性:钾>钠;钾的摩尔质量大于钠;
D.酸性越弱对应盐的水解显碱性,水解程度越大,溶液pH越大.
解答 解:A.图象中1mol氢气完全燃烧生成的是水蒸气时放热241.8kJ,不是氢气的燃烧热,故A错误;
B.2A(g)+2B(g)?3C(g)+D(s),增大压强,平衡正向移动,故B错误;
C.金属性:钾>钠,故钾与水反应的速率快于钠与水反应的速率,钾的摩尔质量大于钠,故等质量的钾、钠分别与足量水反应,钠放出的氢气多,则甲为钠,与图象相符,故C正确;
D.稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化HA溶液PH变化大,故酸性HA>HB,则同浓度的钠盐,水解程度:NaA<NaB,所以同浓度的NaA溶液的pH小于NaB溶液,故D错误;
故选C.
点评 本题考查图象的分析判断,涉及的知识点较多,题目较为综合,题目难度中等.理解图象含义和变化趋势是解题的关键.


科目:高中化学 来源: 题型:选择题

| A. | 用装置甲除去乙酸乙酯中混有的少量乙酸 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 用装置丙制取无水MgCl2 | |
| D. | 用装置丁制取乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 科学家根据元素的原子结构和性质,把它们科学有序地排列起来,得到了元素周期表 | |
| B. | 原子序数是按元素原子核电荷数递增的顺序给元素编的号 | |
| C. | 元素周期表上对金属元素、非金属元素用不同的颜色做了区分 | |
| D. | 元素周期表共有7个周期,18个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
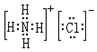 ,其中存在的化学键类型为离子键和共价键.
,其中存在的化学键类型为离子键和共价键. ;元素D最高价氧化物的水化物的化学式为H3PO4或HPO3.
;元素D最高价氧化物的水化物的化学式为H3PO4或HPO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2在葡萄糖中作抗氧化剂 | B. | Fe3O4常用作红色油漆和涂料 | ||
| C. | SiO2可制成太阳能电池 | D. | 漂粉精可用于游泳池的消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2 H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| B. | 2Na+H2SO4═Na2 SO4+H2↑ | |
| C. | 3S+6NaOH $\frac{\underline{\;\;△\;\;}}{\;}$ 2Na2S+Na2SO3+3H2O | |
| D. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$ 2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 | 4 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 25.35 | 24.05 | 23.95 | 24.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com