

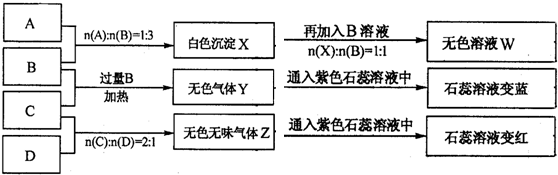
(2)当氯水中不再产生气泡时,某学生欲检验该反应所产生的气体,则该同学可采取的合理操作是_________________________(说明:氯水有一定腐蚀性,操作时需戴橡胶手套)。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
![]()
A.往溶液中先加入稀盐酸,无现象,再加入BaCl2溶液,若生成白色沉淀,则固体M肯定为Na2SO4
B.往溶液中通入二氧化碳,若生成白色沉淀,则固体M为Na2SiO3
C.只用NaOH一种试剂就可以确定该固体M的成分
D.只用盐酸一种试剂就可以确定该固体M的成分
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省实验中学高二上学期期中化学试卷(带解析) 题型:填空题
(15分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。2001年我国卫生部规定,饮用水中ClO2—的含量应不超过0.2mg·L-1。
饮用水中CIO2、CIO2—的含量可用连续碘量法进行测定。CIO2被I—还原为CIO2—、Cl—的转化率与溶液pH的关系如下图所示。当pH≤2.0时,CIO2—也能被I—完全还原成Cl—。反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2==Na2S4O6+2NaI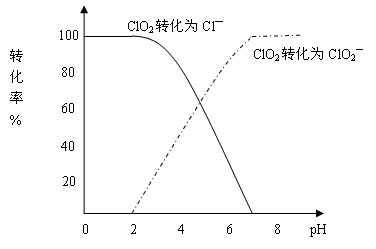
①请写出pH≤2.0时,CIO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的K I晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根⑤据你现有的知识,写出步骤4滴定至终点的现象判断依据为
④根据上述分析数据,测得该饮用水样中CIO2—的浓度为 mol·L-1(用含字母的代数式表示。)
⑤若饮用水中ClO2— 的含量超标,可向其中加入适量的Fe2+将ClO2— 还原成Cl—-, 请猜测该反应的氧化产物是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省四地六校高一上学期第二次月考化学试卷(解析版) 题型:填空题
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。
(1)现有一种无色的鲜花营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验。
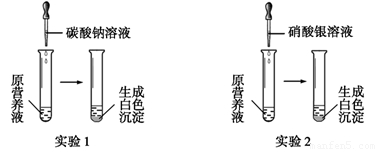
根据以上实验,请你填空。
①由实验1可确定原营养液中一定没有的物质是 (填化学式),写出生成白色沉淀的离子方程式是 。
②若测得原营养液中K+、Cl-的数目之比为2∶1,则原营养液是由 种溶质配制成的。
③某同学用氯化钙、硝酸钾、氯化钾配成的营养液中K+、Cl-、NO3-的数目之比为2∶5∶1,
则所用硝酸钾和氯化钙的物质的量之比是 。
(2)下表是500mL某“鲜花保鲜剂”中含有的成分,阅读后回答下列问题。
|
成分 |
质量(g) |
摩尔质量(g ·mol-1) |
|
蔗糖 |
68.4 |
342 |
|
硫酸钾 |
0.50 |
174 |
|
阿司匹林 |
0.35 |
180 |
|
高锰酸钾 |
0.50 |
158 |
|
硝酸银 |
0.04 |
170 |
①“鲜花保鲜剂”中蔗糖的物质的量浓度为___________________。
②配制该500mL “鲜花保鲜剂”所需的玻璃仪器除了烧杯、玻璃棒、量筒外还有 。
③在溶液配制过程中,下列操作能使配制结果偏小的是___________。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.移液时,液体不小心从外壁流出
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com