
��һ������п��100mL 18.5mol•L��1Ũ�����ַ�Ӧ��п��ȫ�ܽ⣬ͬʱ��������A 33.6L����״����������Ӧ�����Һϡ����1L�������Һ��c��H+��=0.1mol•L��1�������������д�����ǣ�������
| �� | A�� | ����AΪSO2��H2�Ļ���� | B�� | ����A��SO2��H2�������Ϊ1��5 |
| �� | C�� | ��Ӧ�����ĵ�Zn������Ϊ97.5 g | D�� | ��Ӧ�й�ת�Ƶ���3 mol |
| ��ѧ����ʽ���йؼ��㣮 | |
| ר�⣺ | �����⣮ |
| ������ | п��Ũ���ᷢ����Zn+2H2SO4=ZnSO4+SO2��+H2O�����ŷ�Ӧ�Ľ��У�����Ũ�Ƚ��ͣ�������Zn+H2SO4=ZnSO4+H2������������ΪSO2��H2�Ļ������ʵ���Ϊ |
| ��� | �⣺������������ʵ���Ϊ �μӷ�Ӧ��n��H2SO4��=0.1L��18.5mol/L��0.05mol=1.8mol�����ŷ�Ӧ�Ľ��У������Ũ����С�� �跴Ӧ����xmolSO2��ymolH2�� Zn+2H2SO4��Ũ��=ZnSO4+SO2��+H2O x 2x x Zn+H2SO4��ϡ��=ZnSO4+H2�� y y y x+y=1.5 2x+y=1.8 ��֮�� x=0.3��y=1.2 ���Է�Ӧ����0.3mol�Ķ��������1.2mol�������� A�������ϼ����֪������33.6L����״��������A Ϊ��������������Ļ��������A��ȷ�� B����Ӧ����0.3mol�Ķ��������1.2mol������������A��SO2��H2�������Ϊ1.2��0.3=4��1����B���� C����Ӧ�й����Ľ���Zn������m��Zn��=��0.3mol+1.2mol����65g/mol=97.5g����C��ȷ�� D���ڷ�ӦZn+2H2SO4��Ũ��=ZnSO4+SO2��+H2O�У�����0.3mol�Ķ�������ת�Ƶ���Ϊ0.6mol����ӦZn+H2SO4��ϡ��=ZnSO4+H2���У�����1.2mol����ת�Ƶ���2.4mol�����Է�Ӧ�й�ת��3mol���ӣ���D��ȷ�� ��ѡC�� |
| ������ | ���⿼�鷽��ʽ����ؼ��㣬��Ŀ�Ѷ��еȣ�ע��Ũ�����ϡ�������ʵIJ�ͬ���������غ�ĽǶȽ����⣬����������������ʵ�����ϵ�ǽ�����Ĺؼ��� |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ABS������֬���ɱ�ϩ�棨CH2��CHCN������A����1��3������ϩ��CH2��CHCH��CH2������B���ͱ���ϩ��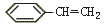 ������S����һ����ȹ��۶��á���Ԫ�ط�����֪��ABS��Ʒ�����ΪCaHbNc��a��b��cΪ������������ԭ����A��B�����ʵ���֮����a��b��c��ʾ��(�� ��)
������S����һ����ȹ��۶��á���Ԫ�ط�����֪��ABS��Ʒ�����ΪCaHbNc��a��b��cΪ������������ԭ����A��B�����ʵ���֮����a��b��c��ʾ��(�� ��)
A��2c����b��a�� B��c����b��a�� C.��b��a������2c�� D����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ��ȷ���ǣ� ��
A���������еμӰ�ˮ��H+ + OH- = H2O
B��Fe(OH)3��������Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C��ͭ����ϡ���3Cu + 8H+ + 2NO3- = 3Cu2+ + 2 NO ��+ 4H2O
D��CuSO4��Һ��Ba(OH)2��Һ��ϣ�Ba2++SO42-=BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2a L��Al2��SO4��3�ͣ�NH4��2SO4�Ļ������Һ��Ϊ���ȷݣ�����һ�ݼ���b mol BaCl2��ǡ��ʹ��Һ�е�SO42��������ȫ��������һ�ݼ�������ǿ����ȿɵõ�c mol NH3������ԭ�����Һ�е�Al3+����Ũ�ȣ�mol/L��Ϊ��������
| �� | A�� |
| B�� |
| C�� |
| D�� |
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������K2CO3��Һ�л����صμ�ϡ���ᣬ�����Ͻ��裮��������ļ��룬��Һ��������ĿҲ��Ӧ�ط�����ͼ�仯���������ߣ�c��dͼ���ص�����Һ�����ӵĶ�Ӧ��ϵ����ȷ���ǣ�������
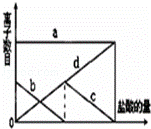
| �� | A�� | a��Cl��b��K+ c��CO32�� d��HCO3�� |
| �� | B�� | a��K+ b��CO32�� c��Cl�� d��HCO3�� |
| �� | C�� | a��K+ b��CO32�� c��HCO3�� d��Cl�� |
| �� | D�� | a��K+b��HCO3�� c��Cl�� d��CO32�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���д�ʩ�����ڽ��ܼ��š����ƻ�����������
�����ƿ�������ȼ�ϵ�����������ٻ�����β����Ⱦ �ڿ����ƹ�̫���ܡ�ˮ�ܡ����ܵ���Դ�� ��ʹ��������δ����������������� ���ƹ�ʹ��ȼú������������SO2��Ⱦ��
A���٢ڢܡ�������B���٢� C���٢ڢۢ� D���ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��A��B��C��D�Ŀ����Ƭ����������ʵ�飺��A��B�õ���������ͬʱ����ϡH2SO4��Һ�У�A��Ϊ��������C��D�õ���������ͬʱ����ϡH2SO4��Һ�У�������D�����ߡ�C����A��C������ͬʱ����ϡH2SO4��Һ�У�C�������������ݣ���B��D������ͬʱ����ϡH2SO4��Һ�У�D������������Ӧ���ݴˣ��ж����ֽ����Ļ��˳����
A��A>B>C>D�� B��A>C>D>B C��C>A>B>D D��B>D>C>A
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijУ�о�ѧϰС��ͬѧ��ʵ��ʱ��SO2ͨ��װ��1mol/LBaCl2��Һ���Թ��У������˰�ɫ�����
��1��ʵ��С���ͬѧ���ݳ����ܽ�ƽ��ԭ�������˹������ϵ�������ݣ����������Ƶ��ó��������¼�ʹ��SO2ͨ��1mol/L BaCl2��Һ�������ͣ�Ҳ����������BaSO3�������ʰ�ɫ������ֻ����BaSO4������Ϊ�����ĵ�����Ϊ�� ��
��2����������ͨ���Ȼ�����Һ�������ϲ�������������ʵ���ܵ���������Һ��������Ӱ��ܿ���ܹ۲쵽��������Ϊ�˱������������ij��ѧС�����������ʵ��װ�ã�ʵ������������£�
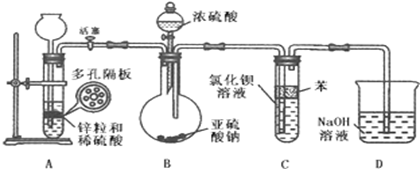
�������Լ����ú���װ��A�еĶ�����Ϸ���п����ͨ�� ȫ��Ʒ��ѧ���� �ú��벻�ˣ�ע��ϡ���ᣮ���������������������뵽����װ�ã�
��D�����ݾ���ð�����鴿ȫ��Ʒ��ѧ���� �ú��벻�ˣ���رջ�������װ��D�ĵ��ܲ����ձ��С�
��ͨ��װ��B�� ȫ��Ʒ��ѧ���� �ú��벻�ˣ��μ�Ũ���ᣬ������������뵽BaCl2��Һ�У���Һ���ֳ��塣
�ܴ������������������������װ��һ��ʱ�䡣
�ݽ�ʢ��BaCl2��Һ���Թܴ�װ����ȡ������ȥ��Ƥ���ý�ͷ�ι����뵽�����·��μ�˫��ˮ���漴���ְ�ɫ���ǣ��μ�ϡ���Ტ����ɫ���Dz���ʧ��
��жװ�ã���ϴ����������ʣ��ҩƷ��
��ش���������
��2��ʵ�鲽��ٺ͢۵Ŀհ״�ʹ�õ��������Ʒֱ�Ϊ �� ȫ��Ʒ��ѧ���� �ú��벻�ˣ���
��3����Ӧ��ʼǰ��������ȡSO2��װ����ͨ�봿����A�в������������������ǣ� ��
��4��װ��C�б��������� ��
��5��װ��D��Ŀ���� ȫ��Ʒ��ѧ���� �ú��벻�ˣ�
��6��д��ʵ�鲽����Թ��з�����Ӧ�Ļ�ѧ����ʽ �� ȫ��Ʒ��ѧ���� �ú��벻�ˣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������(ClO2)��Ŀǰ�����Ϲ��ϵĵ��Ĵ���Ч��
��������������һ�ֻ���ɫ�����壬������ˮ��
��.(1) ClO2����KClO3��H2SO4���ڵ���������Na2SO3��Ӧ�Ƶá���÷�Ӧ�����������뻹ԭ��������ʵ���֮����________��
��.ʵ����Ҳ����NH4Cl�����ᡢNaClO2(��������)Ϊԭ���Ʊ�ClO2�����������£�
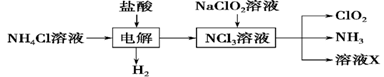
(2) д�����ʱ������Ӧ�Ļ�ѧ����ʽ��____________��
(3) ��ȥClO2�е�NH3��ѡ�õ��Լ���________��(�����)
A������ʳ��ˮ B����ʯ��
C��Ũ���� D��ˮ
(4) �ⶨClO2(����ͼ)�Ĺ������£�����ƿ�м��������ĵ⻯�أ���100 mLˮ�ܽ��
�ټ�3 mL������Һ���ڲ���Һ����м���ˮ�������ɵ�ClO2����ͨ����������ƿ�б����գ�����������е�ˮ��Һ������ƿ�У����뼸�ε�����Һ����c mol·L��1��������Ʊ���Һ�ζ�(I2��2S2O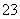 �� 2I����S4O
�� 2I����S4O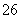 )������ȥV mL�����������Һ��
)������ȥV mL�����������Һ��
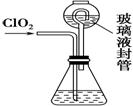
��װ���в���Һ��ܵ�������_______________________________________��
����д��������������������⻯����Һ��Ӧ�����ӷ���ʽ__________________��
�۵ζ��յ��������________________________________________________��
�ܲ��ͨ��ClO2������m(ClO2)��________��(�ú�c��V�Ĵ���ʽ��ʾ)
(5) ��ClO2������������ˮ(pHΪ5.5��6.5)������һ���������岻���������������ClO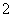
2001���ҹ��������涨������ˮ��ClO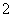 ����Ӧ������0.2 mg·L��1��������ˮ��ClO
����Ӧ������0.2 mg·L��1��������ˮ��ClO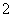 �ĺ������꣬�������м���������Fe2�����÷�Ӧ������������____________ (�ѧʽ)���䷢����Ӧ�����ӷ���ʽΪ_________________ __________��
�ĺ������꣬�������м���������Fe2�����÷�Ӧ������������____________ (�ѧʽ)���䷢����Ӧ�����ӷ���ʽΪ_________________ __________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com