
| A. | 碳酸钙与足量盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应:H++OH-═H2O | |
| C. | 碳酸氢钠溶液与硫酸氢钠溶液反应 HCO3-+H+═CO2↑+H2O | |
| D. | 铝片插入硝酸汞溶液中:Al+Hg2+═Al3++Hg |
分析 A.碳酸钙在离子反应中保留化学式;
C.漏写生成硫酸钡的离子反应;
C.反应生成硫酸钠、水、二氧化碳;
D.电子、电荷不守恒.
解答 解:A.碳酸钙与足量盐酸反应的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故A错误;
B.氢氧化钡溶液与稀硫酸反应的离子反应为Ba2++SO42-+2H++2OH-═2H2O+BaSO4↓,故B错误;
C.碳酸氢钠溶液与硫酸氢钠溶液反应的离子反应为HCO3-+H+═CO2↑+H2O,故C正确;
D.铝片插入硝酸汞溶液中的离子反应为2Al+3Hg2+═2Al3++3Hg,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaHCO3水解:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用石墨作电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 乙醛与新制的Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验淀粉是否发生水解,将淀粉与稀硫酸溶液共热,冷却后,取上层水溶液,用NaOH中和稀硫酸后,再加入Cu(OH)2悬浊液,加热,观察是否产生砖红色沉淀 | |
| B. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变血红色 | |
| C. | 在酸、碱中和滴定终点时不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量溶液进行调整 | |
| D. | 实验室制备氢氧化亚铁,滴加氢氧化钠溶液时应将胶头滴管插入硫酸亚铁溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 纯净物 | 纯硫酸 | 冰醋酸 | 水玻璃 | 胆矾 |
| 混合物 | 水煤气 | 福尔马林 | 冰水混合物 | 漂白粉 |
| 弱电解质 | 氨水 | 氟化氢 | 氨 | 水 |
| 非电解质 | 干冰 | 乙醇 | 三氧化硫 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 布洛芬具有解热镇痛作用,常规剂量使用时,不良反应发生率低,是国内外包括世界卫生组织公认的用于小儿发热的经典解热镇痛药.布洛芬的结构简式如图:
布洛芬具有解热镇痛作用,常规剂量使用时,不良反应发生率低,是国内外包括世界卫生组织公认的用于小儿发热的经典解热镇痛药.布洛芬的结构简式如图: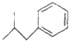 $→_{AlCl_{3}}^{CH_{3}COCl}$A$\stackrel{H_{2}}{→}$
$→_{AlCl_{3}}^{CH_{3}COCl}$A$\stackrel{H_{2}}{→}$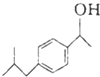 $\stackrel{CO}{→}$布洛芬
$\stackrel{CO}{→}$布洛芬 +
+ $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$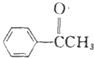 +HCl,请写出A的结构简式
+HCl,请写出A的结构简式

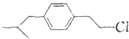 为原料合成布洛芬(用合成路线流程图表示;无机原料任选,并注明反应条件).
为原料合成布洛芬(用合成路线流程图表示;无机原料任选,并注明反应条件). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH4、NH3、H20和HF均为含10e-的分子.
CH4、NH3、H20和HF均为含10e-的分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与15N具有相同的中子数 | |
| B. | 0.012kg 13C所含的碳原子数为阿伏加德罗常数 | |
| C. | 等物质的量的13C17O和15N2,两气体具有相同的质子数、原子数和质量 | |
| D. | 13C、15N和C60、N70互为同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com