
【题目】将浓度均为2mol/LAgNO3与Cu(NO3)2溶液各0.5L混合,以铜电极进行电解,一段时间后,阴极上有1.6g铜析出。
(1)直流电源已输出__mol电子。
(2)溶液中c(Cu2+)为_mol/L。
【答案】1.05 1.5
【解析】
(1)电解AgNO3、Cu(NO3)2的混合液,首先在阴极上得电子的是Ag+,其次是Cu2+,根据产生铜的量计算转移电子的量;
(2)根据公式![]() ,计算溶液中Cu2+的浓度。
,计算溶液中Cu2+的浓度。
(1)电解AgNO3、Cu(NO3)2的混合液,首先在阴极上得电子的是Ag+,Ag++e=Ag,其次是Cu2+,Cu2++2e=Cu,在阳极上是Cu-2e-=Cu2+;n(Ag+)=2mol/L×0.5L=1mol,1mol Ag+全部反应会得1mol电子,阴极上有1.6gCu析出,n(Cu)=m/M=1.6g÷64g·mol-1=0.025mol,根据Cu2++2e=Cu,生成0.025molCu,转移0.05mol电子,所以转移电子总量是1.05mol,故答案为:1.05;
(2)阳极上Cu2e=Cu2+,当转移1.05mol电子,会有0.525mol的Cu2+进入电解质,原来溶液剩余Cu2+的物质的量为:1mol0.025mol=0.975mol,此时溶液中共含有Cu2+的物质的量为1.5mol,铜离子浓度为:![]() ,故答案为:1.5。
,故答案为:1.5。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I.字母 A~K 代表常见物质,在一定条件下能发生如图所示变化
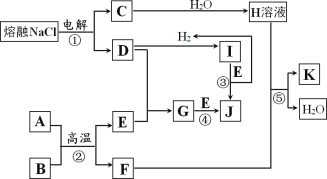
已知:反应②中A为红棕色粉末,B为金属单质,且n(A):n(B)=1:2,反应③和反应④均在水溶液中进行。
(1)保存 J 的方法是:_____。
(2)写出反应②的化学方程式:_____。
II.某研究性学习小组的同学以 Fe(NO3)3溶液来探究 Fe3+能否氧化 Ag 为题。他们选用少量的Fe(NO3)3 溶液与做过银镜反应的试管进行实验。现象:银镜部分溶解,试管上方出现少量淡淡的红棕色气体。
(1)出现少量淡淡的红棕色气体,该气体是_____。
(2)若 Fe3+能否氧化 Ag,只需证明:_____方法是:_____
Ⅲ. 铁红是一种红色颜料,其成分是 Fe2O3 ,将一定量的铁红溶于 180mL 5mol·L-1 盐酸中,在加入一定量铁粉恰好溶解,收集到 3.36L(标准状况)气体。
(1)按反应顺序写出离子方程式_____
(2)反应后的溶液中一定没有 Fe3+,理由是_____
(3)参加反应的铁粉的质量为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法不正确的是

A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法
B.氯碱工业中采用阳离子交换膜可提高产品的纯度
C.由MgCl2·6H2O得到无水MgCl2的关键是要在干燥的氯化氢气流低温小火烘干
D.溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、④、⑤中均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某有机物样品3.0g通入足量的氧气后充分燃烧,在120℃条件下将燃烧后的气体通入足量的浓H2SO4中,浓H2SO4增重1.8g,然后将气体再通入足量的氢氧化钡溶液中,可得到沉淀19.7g(不考虑溶解的沉淀物),此时还有标准状况下的气体2.24L,该气体能用于抢救危重病人。实验测得该有机物蒸气的密度是相同条件下氦气的15倍。求该有机物的分子式和通入氧气的总体积(标准状况)?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是![]() (铁酸镍)、NiO、FeO、CaO、
(铁酸镍)、NiO、FeO、CaO、![]() 等,以下是从该矿渣中回收
等,以下是从该矿渣中回收![]() 的工艺路线:
的工艺路线:
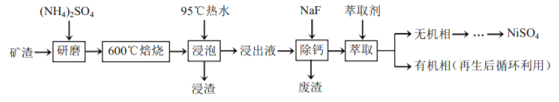
已知:![]() 在350℃以上会分解生成
在350℃以上会分解生成![]() 和
和![]() 。
。![]() 在焙烧过程中生成
在焙烧过程中生成![]() 、
、![]() 。锡(Sn)位于第五周期第ⅣA族。
。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与![]() 混合研磨,混合研磨的目的是________。
混合研磨,混合研磨的目的是________。
(2)“浸泡”过程中![]() 生成
生成![]() 的离子方程式为________,“浸渣”的成分除
的离子方程式为________,“浸渣”的成分除![]() 、
、![]() 外还含有________(填化学式)。
外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入![]() 将
将![]() 还原为
还原为![]() ,所需
,所需![]() 的物质的量不少于
的物质的量不少于![]() 物质的量的________倍;除去过量的
物质的量的________倍;除去过量的![]() 后,再用酸性
后,再用酸性![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,还原产物为
,还原产物为![]() ,滴定时反应的离子方程式为________。
,滴定时反应的离子方程式为________。
(4)“浸出液”中![]() ,当除钙率达到99%时,溶液中
,当除钙率达到99%时,溶液中![]() ________
________![]() [已知
[已知![]() ]
]
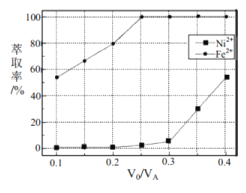
(5)本工艺中,萃取剂与溶液的体积比(![]() 对溶液中
对溶液中![]() 、
、![]() 的萃取率影响如图所示,
的萃取率影响如图所示,![]() 的最佳取值是________。
的最佳取值是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,金属单质X和非金属单质Y能够反应,生成化合物Z,Z能与水发生水解反应生成气体G和白色沉淀P(如下框图所示),已知气体G与空气之密度比约为1.17。请填空:
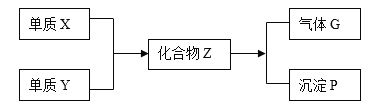
(1)组成单质X和Y的元素分别属第____________族和第___________族;
(2)Z与水发生水解反应方程式_____________________;
(3)每生成1mol的化合物Z,反应中转移_________________mol的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、F是C8H18裂解后的两种常见产物,二者互为同系物。A的产量可以用来衡量一个国家的石油化工发展水平,H是高分子化合物。由C8H18制备E、H的流程如下:
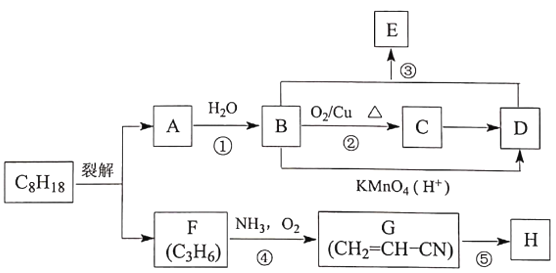
回答下列问题:
(1)C的结构简式为________________,D中官能团的名称为________________
(2)反应①的化学方程式为________________,所属反应类型为________________
(3)反应③的化学方程式为________________,实验室制备E使用饱和Na2CO3溶液的作用是________________
(4)检验F中官能团的试剂是__________,反应⑤的化学方程式为________________
(5)C8H18存在多种同分异构体,其中一氯代物只有1种的有机物的结构简式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为____________,S、O、N三种元素的第一电离能由大到小为____________。
(2)SO42-的立体构型是________,与SO42-互为等电子体的一种分子为____________(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有____________。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是____________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为________,它代表________原子。
)。则D原子的坐标参数为________,它代表________原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,在三个干燥的烧瓶内分别装有纯净的NH3,含一半空气的HCl气体, NO2 和O2的混合气体[V(NO2)∶V(O2) = 4∶1 ],然后分别作喷泉实验,三个烧瓶内所得溶液的物质的量浓度之比为
A. 2∶1∶2 B. 5∶5∶4 C. 1∶1∶1 D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com