【答案】
分析:(1)由图象可知v(CO
2),根据反应速率之比等于化学计量数之比计算氢气的反应速率,根据反应消耗的二氧化碳计算反应热;
(2)计算出平衡时各物质的浓度,根据平衡常数表达式计算;
(3)为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量;
(4)催化剂中毒可使反应难以进行.
解答:解:(1)由图象可知v(CO
2)=
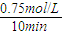
=0.075mol/(L?min),根据反应速率之比等于化学计量数之比可知v(H
2)=3v(CO
2)=3×0.075mol/(L?min)=0.225 mol/(L?min),
在这段时间内,反应消耗的CO
2为1L×0.75mol/L=0.75mol,所以反应放出的热量为0.75mol×49.0KJ/mol=36.75kJ,
故答案为:0.225 mol/L?min; 36.75kJ;
(2)CO
2(g)+3H
2(g)

CH
3OH(g)+H
2O(g)
起始:1mol 3mol 0 0
转化:0.75mol 2.25mol 0.75mol 0.75mol
平衡:0.25mol 0.75mol 0.75mol 0.75mol
所以:达到平衡时,c(CO
2)=0.25mol/L,c(H
2)=0.75mol/L,c(CH
3OH)=0.75mol/L,c(H
2O)=0.75mol/L,
在该条件下,反应的平衡常数K的值=
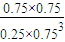
=5.3,只改变浓度,使c(CO
2)=1.00mol/L,c(H
2)=0.40mol/L,c(CH
3OH)=c(H
2O)=0.80mol/L,
则此时Qc=
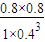
=10>K,则平衡向逆反应方向移动,故选b,故答案为:5.3;b;
(3)a、升高温度,平衡向逆反应方向移动,甲醇与二氧化碳的物质的量比值减小,故a错误;
b、充入He(g),使体系压强增大,但对反应物质没有影响,平衡不移动,二者比值不变,故b错误;
c、将H
2O(g)从体系中分离,生成物的浓度减小,平衡向正反应方向移动,二者比值变大,故c正确;
d、再充入l mol CH
3OH(g),反应虽然向逆反应方向移动,但反应的比增加的少,二者比值增大,故d正确.
故答案为:cd;
(4)如杂质使催化剂中毒,则反应难以进行,故答案为:催化剂中毒.
点评:本题考查化学平衡的有关计算,本题难度不大,做题时注意平衡常数的计算和应用.

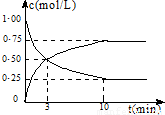
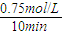 =0.075mol/(L?min),根据反应速率之比等于化学计量数之比可知v(H2)=3v(CO2)=3×0.075mol/(L?min)=0.225 mol/(L?min),
=0.075mol/(L?min),根据反应速率之比等于化学计量数之比可知v(H2)=3v(CO2)=3×0.075mol/(L?min)=0.225 mol/(L?min),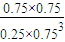 =5.3,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,
=5.3,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,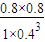 =10>K,则平衡向逆反应方向移动,故选b,故答案为:5.3;b;
=10>K,则平衡向逆反应方向移动,故选b,故答案为:5.3;b;

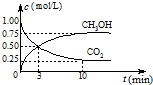
 (2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.
(2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.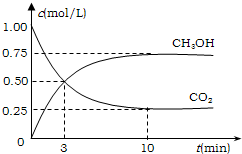 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,先进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,先进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.