
【题目】氧化还原是一类重要的反应。
(1)已知反应2I-+2Fe3+=I2+2Fe2+,反应中还原剂是_________,氧化性Fe3+______I2 (填“ < ”或“ > ”) 。
(2)在2Na2O2+2CO2=2Na2CO3+O2反应中,若转移3mol电子,则所产生的氧气在标准状况下的体积为___________L。
(3)在xR2++yH++O2═mR3++nH2O的离子方程式中,对系数m和R2+、R3+判断正确的是__。
A.m=y,R3+是还原剂 B.m=2y,R2+被氧化
C.m=2,R3+是氧化剂 D.m=4,R2+是还原剂
(4)用双线桥标出反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中电子转移的方向和数目_________。
(5)氯气和石英砂、碳粉共热可发生反应:SiO2+2C+2Cl2![]() SiCl4+2CO当反应消耗6g碳时,生成还原产物_________mol。
SiCl4+2CO当反应消耗6g碳时,生成还原产物_________mol。
【答案】 I- > 33.6 D  0.25
0.25
【解析】(1)碘离子氧化为碘单质,反应中做还原剂;Fe3+价态降低,发生还原反应,做氧化剂,碘单质为氧化产物,因此氧化性:Fe3+>I2;正确答案:I- ; >。
(2)在2Na2O2+2CO2=2Na2CO3+O2反应中,转移电子的量为2mol,生成氧气1 mol;若转移3mol电子,则所产生的氧气在标准状况下的体积为1.5×22.4= 33.6 L;
(3)在xR2++yH++O2═mR3++nH2O的离子方程式中,R2+→R3+,发生氧化反应,O2→H2O,发生还原反应,因此R2+是还原剂,被氧化,根据原子守恒规律可知:x=m, y=2n, 又知n=2,所以y=4,根据电荷守恒规律可知:2m+ y=3m,m=y=4,因此m=4,R2+是还原剂正确,正确答案:D。
(4)KMnO4中Mn元素为+7价降低到MnCl2中的+2价,2molKMnO4转移电子的量为2×5=10 mol;16molHCl(浓)中有10molHCl被氧化5mol Cl2,转移电子用双线桥标出电子转移的方向和数目如下: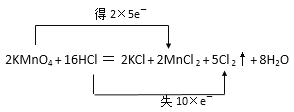 ;正确答案:
;正确答案: 。
。
(5)该反应中碳做还原剂,被氧化,对应氧化物产物为CO;氯气做氧化剂,被还原,对应还原产物为SiCl4,根据反应关系:2C--- SiCl4可知当反应消耗6g碳时(即0.5 mol)时, 生成SiCl4的量为0.25 mol,正确答案:0.25。


科目:高中化学 来源: 题型:
【题目】下列各图与表述一致的是( )
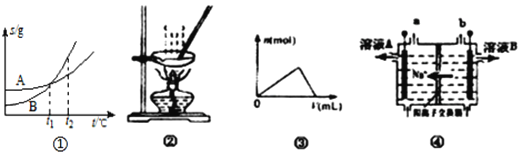
A. 图①表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A
B. 用图②所示装置蒸发FeCl3溶液制备无水FeCl3
C. 图③可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化
D. 图④电解饱和食盐水的装置中,溶液B为浓氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如表:
元素 | 相关信息 |
A | 原子核外L层电子数是K层的2倍 |
B | 其一种单质被称为地球生物的“保护伞” |
C | 元素的第一电离能是第3周期所有元素中最小的 |
D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第周期、第族;D的基态原子核外电子排布式是 .
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) , B、D的简单氢化物中稳定性较大的是 .
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为;该化合物属于晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是 .
(5)已知:2AB(g)+B2(g)═2AB2(g)△H=﹣566.0kJmol﹣1
D(s)+B2(g)═DB2(g)△H=﹣296.0kJmol﹣1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N4分子结构为正四面体(如图所示)。已知:断裂N4(g)中1 molN-N键吸收193kJ能量,形成N2(g)中1 mol N![]() N放出941 kJ能量。下列说法正确的是
N放出941 kJ能量。下列说法正确的是
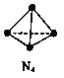
A. N4(g)比N2(g)更稳定
B. N4(g)=2N2(g) △H=+724kJmol-1
C. 形成1 mol N4(g)中的化学键放出193 kJ的能量
D. lmolN2(g)完全转化为N4(g),体系的能量增加362kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为短周期元素,可形成A2C和BC2两种化合物.A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外能层电子数比K层多2个,而C原子核外的最外能层电子数比次外层电子数少2个.
(1)它们的元素符号分别为:A;B;C;
(2)BC2是由键组成的(填“极性”或“非极性”)分子.
(3)画出C原子的核外电子排布图 .
(4)A2C和BC2的空间构形分别是和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
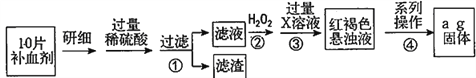
请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该硫酸试剂的物质的量浓度为18.4 mol/L
B.稀释该硫酸时应把水倒入硫酸中,边倒边搅拌
C.50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol
D.标准状况下2.7 g Al与足量的该硫酸反应可得到H2 3.36 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如图.下列有关绿原酸的说法中不正确的是( ) 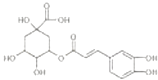
A.绿原酸分子中有4个手性碳原子
B.绿原酸能发生显色反应、取代反应和加成反应
C.每摩尔绿原酸最多与4 mol NaOH反应
D.绿原酸分子中所有碳原子都能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是离子反应,又是氧化还原反应的是
A.氯化钠溶液中滴入硝酸银溶液
B.铁片置于硫酸铜溶液中
C.铁在氧气中燃烧
D.二氧化碳通入澄清石灰水中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com