
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
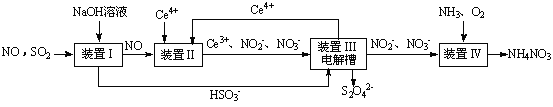
(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。
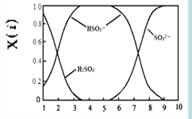
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
【知识点】无机流程、溶液中的离子浓度大小、电化学、计算
【答案解析】 (1)SO2 + OH-=== HSO3-(2分);
(2)①a、c (3分)
②HSO3- SO32-+H+,加入CaCl2溶液, Ca2++SO32-=== CaSO3↓使平衡右移,c(H+)增大。(3)NO+2H2O+3Ce4+===3Ce3++NO3-+4H+(3分)
SO32-+H+,加入CaCl2溶液, Ca2++SO32-=== CaSO3↓使平衡右移,c(H+)增大。(3)NO+2H2O+3Ce4+===3Ce3++NO3-+4H+(3分)
(4)①Ce3+- e-=== Ce4+ (2分) ② a (2分)
(5)243a(242a、244a、5600a /23都给分)(3分)
解析:(1)进入装置Ⅰ中的物质有:NaOH、NO、SO2,则生成HSO3-的离子方程为:
SO2 + OH-=== HSO3-
(2)①如图pH=8时,溶液中c(HSO3-) < c(SO32-)a正确。pH=7时,溶液中c(Na+)+c(H+) =c(HSO3-)+2c(SO32-)+c(OH-),c(H+)= c(OH-),所以b不正确。如图pH控制在4~5左右,溶液中没有HSO3-,所以c错。②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2原因为HSO3- SO32-+H+,加入CaCl2溶液, Ca2++SO32-=== CaSO3↓使平衡右移,c(H+)增大。
SO32-+H+,加入CaCl2溶液, Ca2++SO32-=== CaSO3↓使平衡右移,c(H+)增大。
(3)装置Ⅱ中,如流程图反应物为NO、Ce4+生成物有Ce3+、NO3-。根据电荷守恒和题意给出酸性溶液,反应物还有H2O,生成物还有H+。根据氧化还原原理和得失电子守恒配平得NO+2H2O+3Ce4+===3Ce3++NO3-+4H+。
(4)①根据流程图其电极方程式只能是Ce3+- e-=Ce4+。②由Ce3+- e-= Ce4+得阳极生成Ce4+,所以从电解槽的a口流出。
(5)根据得失电子守恒NO2-和O2的物质的量之比为2:1。得氧气的体积为 =243a 。
=243a 。
【思路点拨】本题考查了离子方式、电极方程式的书写,溶液中浓度大小的比较,氧化还原反应,利用电荷守恒计算。题目难度较大。注意从已知提取信息,培养看图分析能力。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是
A.lmol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L0.5 mol • L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mo l Na2O2固体中含离子总数为4NA
l Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体 中氢原子的个数为6 NA
中氢原子的个数为6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列物质中互为同分异构体的有________;互为同素异形体的有________;互为同位素的有________;互为同一物质的有________(填序码):
(1)液氯 (2)氯气 (3)白磷 (4)红磷 (5)35Cl (6)37Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
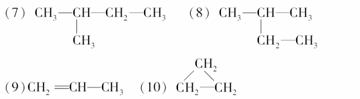
以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高的特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示,下列关于直接氨固体氧化物燃料电池的说法正确的是( )
A.该电池工作时的总反应为4NH3+5O2===4NO+6H2O
B.固体氧化物作为电池工作的电解质,其作用是让电子在电池内移动
C.电池工作时,在接触面上发生的电极反应为2NH3+3O2--6e-===N2+3H2O
D.外电路的电流方向为从电极a流向电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
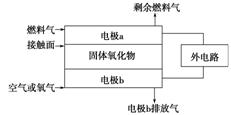
控制适合的条件,将反应2Fe3++2I- 2Fe2+I2,
2Fe2+I2,
设计成如图所示的原电池。下列判断不正确的是
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
发展混合动力车是实施节能减排的重要措施之一。混合动力车的电动机目前一般使用的是镍氢电池。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液.镍氢电池充放电原理如图,其总反应式为: H2+2NiOOH 2Ni(OH)2
2Ni(OH)2
下列有关混合动力车的判断正确的是( )
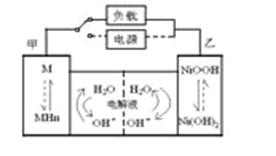
A.在上坡或加速时,每消耗22.4LH2,从电极甲流向电极乙的电子是2mol
B.在上坡或加速时,乙电极周围溶液的pH将减小
C.在刹车和下坡时,溶液中的K+向乙电极迁移
D.在刹车和下坡时,甲电极的电极反应式为2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有KI溶液的试管中加入 少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
请完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
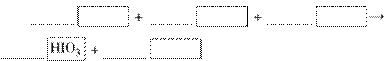
(2)整个过程中的还原剂是________。
(3)把KI换成KBr,则CCl4层变为________色;继续滴加氯水,CCl4层的颜色没有变化。Cl 2、HIO3、HBrO3氧化性由强到弱的顺序是________。
2、HIO3、HBrO3氧化性由强到弱的顺序是________。
(4)加碘盐中含碘量为20 mg~50 m/kg。制取加碘盐(含KIO3的食盐)1000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2________L(标准状况,保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO →I2 MnO
→I2 MnO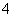 →Mn2+ HNO2→NO
→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2 B.IO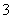
 C.MnO
C.MnO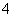 D.HNO2
D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将1.92 g铜加入到100 mLH2SO4和HNO3的混合液中,Cu全部溶解,放出无色气体,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448 mL(标准状况)的氢气。下列有关结论不正确的是( )
A. 溶解的铁粉为2.8 g
B. 原溶液中(SO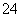 )=0.5 mol·L-1
)=0.5 mol·L-1
C. 原混合溶液中(H+)=1.2 mol·L-1
D. 原溶液中(NO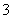 )=0.08 mol
)=0.08 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com