
| A. | 仅含碳、氢元素的有机物称为烃 | |
| B. | 1,2-二溴乙烷是无色液体 | |
| C. | 溴苯的密度比水大 | |
| D. | 四氟乙烯(CF2=CF2)中含有碳碳双键,属于烯烃 |
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
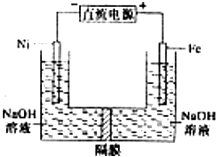 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )| A. | 铁是阳极,电极反应为 Fe-6e-+4H2O=FeO42-+8H+ | |
| B. | 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 | |
| C. | 若隔膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42- | |
| D. | 电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加 | |
| B. | 化学反应速率为“0.8 mol/(L•s)”表示的意思是:时间为1 s时,某物质的浓度为0.8 mol/L | |
| C. | 对于任何化学反应来说,反应速率越大,反应现象越明显 | |
| D. | 根据化学反应速率的大小可以知道化学反应进行的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O的质量为18g•mol-1 | |
| B. | 标准状况下,1 mol任何物质体积均为22.4L | |
| C. | 3.01×1023个NH3分子的质量为8.5g | |
| D. | CH4的摩尔质量为16g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和  ④CH3CH2CH3和CH3CH3 ⑤氕和氘 ⑥CH3CH2CH2CH2CH3和CH3C(CH3)3
④CH3CH2CH3和CH3CH3 ⑤氕和氘 ⑥CH3CH2CH2CH2CH3和CH3C(CH3)3查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 4.4g | C. | 8.8g | D. | 4.4~8.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com