
| A、含2NA个氢分子的氢气 |
| B、17g氨气(NH3的摩尔质量为17g?mol-l) |
| C、0.8mol氧气 |
| D、标准状况下11.2 L氯气 |
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
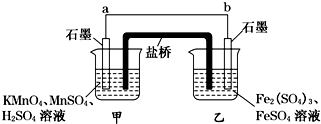
科目:高中化学 来源: 题型:
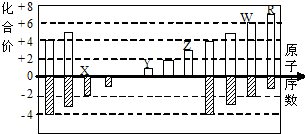
| A、原子半径:R>Y>X |
| B、气态氢化物的稳定性:R>W |
| C、WX3和水反应形成的化合物具有挥发性 |
| D、Z能和Y的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,pH=1的溶液中:Na+、Fe2+、NO-3、SO42- |
| B、由水电离的c(H+)=1×10-13 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| C、含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- |
| D、c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78g Na2O2与足量水充分反应时电子转移数为2NA |
| B、1 mol Na完全转化为Na2O2时,失去的电子数目为2NA |
| C、4℃、101.3kPa时,54mL H2O中含有的分子数为3NA |
| D、2L1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
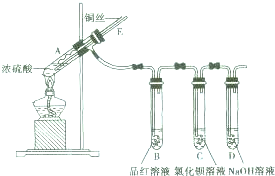 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示.实验步骤:
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示.实验步骤:| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:
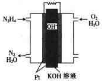 燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题:
燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com