
| A. | 核外有38个电子,核内有95个质子 | B. | 核外有38个电子,核内有57个中子 | ||
| C. | 核外有57个电子,核内有57个质子 | D. | 核外有57个电子,核内有38个质子 |
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
 H++B(OH)4-.
H++B(OH)4-.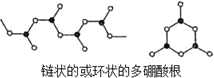 ,其组成可表示为(BO2)nn-.
,其组成可表示为(BO2)nn-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸可刻蚀石英制艺术品 | |
| B. | 活性炭、SO2和Na2O2都具有漂白作用,且漂白的化学原理相同 | |
| C. | 石油的裂化、煤的气化、Na2FeO4杀菌消毒均属于化学变化 | |
| D. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
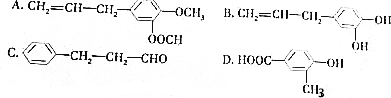
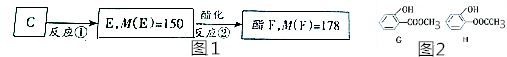
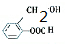 、
、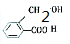 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000a%}{98x}$g/ml | B. | $\frac{x}{98a%}$g/mol | C. | $\frac{98x}{a%}$g/ml | D. | $\frac{98x}{10a}$g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
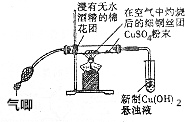 在完成“乙醇的催化氧化实验“后,某学校化学兴趣小组认为该实验方案存在着明显的缺点.
在完成“乙醇的催化氧化实验“后,某学校化学兴趣小组认为该实验方案存在着明显的缺点.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
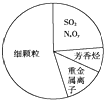
| A. | SO2和NxOy都属于酸性氧化物 | |
| B. | 雾属于胶体,能产生丁达尔效应 | |
| C. | 重金属离子可导致蛋白质变性 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
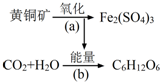 利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com