
| A.用明矾净化饮用水 |
| B.用过滤的方法除去粗盐中的泥沙 |
| C.用煤油保存少量的金属钠 |
| D.用分液的方法分离酒精和水 |
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.溶液中水电离出的OH-的个数:②>① |
| B.溶液中阴离子的物质的量浓度之和:②>① |
| C.①溶液中:c(CO32-)<c(H2CO3) |
| D.②溶液中:c(HCO3-)<c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 化学式 | ①AgCl | ②AgBr | ③Ag2S | ④Ag2CrO4 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 2.0×10-48 | 2.0×10-12 |
| c(Br-) |
| c(Cl-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )
Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )| A.2 | B.3 | C.4 | D.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.连接好仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
 SO2 +2Cu。
SO2 +2Cu。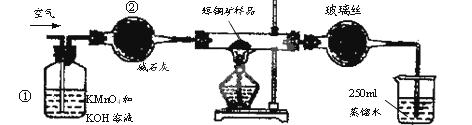
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH值 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com