
| 元素编号 | 元素性质或原子结构 |
| T | M层上有3个未成对电子 |
| X | 3p能级上有一个空轨道 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 3d能级上只有1对成对电子 |

 ,所以B正确;
,所以B正确;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
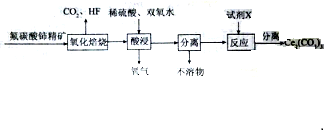
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将浓度为0.1mol?L-1HF溶液加水不断稀释过程中,c(H+)和c(OH-)都会减小 |
| B、常温下,为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的PH,若PH>7,则H2A是弱酸;若PH<7,则H2A是强酸 |
| C、将SO2通入一定量的KOH溶液,所得溶液呈中性,该溶液中一定含KHSO2 |
| D、用0.2000mol?L-1NaOH标准溶液滴定浓度均为0.1mol?L-1的HCl与CH3COOH的混合液,至中性时,溶液中的酸恰好被完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅酸凝胶干燥后可作实验室、袋装食品和瓶装药品的干燥剂 |
| B、硅可做半导体材料 |
| C、二氧化硅是现代光学及光纤制品的基本原料 |
| D、碳化硅是做电子组件的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com