

分析 (1)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;由图1可知,Ⅱ中反应物总能量高于生成物总能量,反应Ⅱ为放热反应;
(2)活化能越高,反应速率应越慢;
(3)①开始时,反应Ⅰ速率大于反应Ⅱ速率,所以生成苯硫酚浓度大于苯;反应Ⅰ达到平衡后,温度升高,平衡逆向移动,所以生成物苯硫酚浓度减小;反应Ⅱ是不可逆反应,温度升高反应速率加快,生成的苯浓度增加,消耗了反应物,进一步导致反应Ⅰ逆向移动;
②由图三可知,R=2.5时PhSH浓度最大,由图二可知,温度590K时PhSH浓度最大;
(4)恒温恒容条件下,苯硫酚的物质的量随反应进行浓度增大,到达平衡后浓度大最大,而平衡后苯浓度增加,消耗了反应物,导致反应Ⅰ逆向移动,苯硫酚的物质的量减小.
解答 解:(1)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,反应Ⅰ的平衡常数的表达式K=$\frac{c(PhSH)×c(HCl)}{c(PhCl)×c({H}_{2}S)}$;由图1可知,Ⅱ中反应物总能量高于生成物总能量,反应Ⅱ为放热反应,故△H<0,
故答案为:$\frac{c(PhSH)×c(HCl)}{c(PhCl)×c({H}_{2}S)}$;<;
(2)活化能Ⅱ>I,活化能越高,单位体积内活化分子数目越小,反应速率应越慢,故反应速率v(Ⅰ)>v(Ⅱ),
故答案为:>;
(3)①开始时,反应Ⅰ速率大于反应Ⅱ速率,所以生成苯硫酚浓度大于苯;反应Ⅰ达到平衡后,温度升高,平衡逆向移动,所以生成物苯硫酚浓度减小;反应Ⅱ是不可逆反应,温度升高反应速率加快,生成的苯浓度增加,消耗了反应物,进一步导致反应Ⅰ逆向移动,PhSH的浓度又降低,
故答案为:开始时,反应Ⅰ速率大于反应Ⅱ速率,所以生成苯硫酚浓度大于苯;反应Ⅰ达到平衡后,温度升高,平衡逆向移动,所以生成物苯硫酚浓度减小;反应Ⅱ是不可逆反应,温度升高反应速率加快,生成的苯浓度增加,消耗了反应物,进一步导致反应Ⅰ逆向移动;
②由图三可知,R=2.5时PhSH浓度最大,由图二可知,温度590K时PhSH浓度最大,故采取措施为:,
故答案为:R=2.5,温度控制在590K;
(4)恒温恒容条件下,苯硫酚的物质的量随反应进行浓度增大,到达平衡后浓度大最大,而平衡后苯浓度增加,消耗了反应物,导致反应Ⅰ逆向移动,苯硫酚的物质的量减小,苯硫酚的物质的量随时间变化的曲线图为: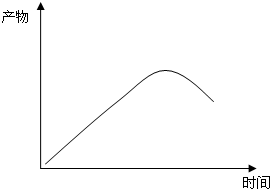 ,
,
故答案为: .
.
点评 本题考查化学反应速率及化学平衡图象综合应用、平衡常数、化学反应能量变化等,是对学生综合能力的考查,难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
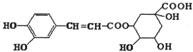
| A. | 该有机物在一定条件下可以发生消去反应 | |
| B. | 1mol该有机物与足量的溴水反应时最多消耗4molBr2 | |
| C. | 该有机物不能使酸性高锰酸钾溶液褪色 | |
| D. | 该有机物在一定条件下可以发生水解反应和酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒元素的非金属性比溴元素的弱 | |
| B. | 硒的最高价氧化物的水化物的分子式为:H2SeO3 | |
| C. | 硒在周期表中位于第五周期VIA族 | |
| D. | 硒的气态氢化物的稳定性比硫化氢强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Y | Z | M | |
| W |
 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①③⑤⑦ | C. | ②④⑥⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
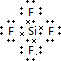
| A. | X的离子半径>Y的离子半径 | |
| B. | Z的氢化物稳定性>W的氢化物稳定性 | |
| C. | 化合物X2W2和Y2W3中都不含配位键 | |
| D. | 1 mol ZW2晶体所含Z-W键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2CO3<HSO4<HClO4 | D. | 熔点:Na>K>Rb |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com