
【题目】在水溶液中能大量共存,且加入过量稀硫酸时,有气体生成的是( )
A. Na+ 、Ag+ 、CO32- 、Cl- B. H+ 、K+、NH4+、OH-
C. Na+ 、K+ 、CO32- 、Cl- D. Na+ 、K+ 、Cl- 、SO42-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3溶液中存在水解平衡:CO32﹣+H2OHCO3﹣+OH﹣ . 下列说法不正确的是( )
A.通入CO2 , 溶液pH减小
B.加入少量NH4Cl固体,平衡向正反应方向移动
C.慢慢升高温度, ![]() 逐渐减小
逐渐减小
D.加入NaOH 固体后冷却到室温,溶液的KW=c(OH﹣)?c(H+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中可存在电离平衡,水解平衡,溶解平衡,依据所学回答下列问题.
(1)等物质的量浓度的下列四种溶液:①NH3H2O ②(NH4)2SO3 ③KHSO3 ④K2SO3溶液中水的电离程度由大到小的排列顺序为(填序号).
(2)体积相同、c(H+)相同的三种酸溶液①CH3COOH;②HCl;③H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是(填序号).将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为(填序号).
(3)已知,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ/mol.实验测得稀醋酸与稀NaOH溶液反应生成1mol H2O时放出57kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为 .
(4)25℃时,NH3H2O的电离常数为Kb=1.7×10﹣3 . 0.1molL﹣1NH4Cl溶液的pH=a,则c(NH4+):c(NH3H2O)=(用含a的代数式表示)
(5)某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),其中正确的有①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低②pH=2的盐酸与pH=13的NaOH溶液,按体积比9:1混合后的溶液pH为11
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH.其溶液物质的量浓度由小到大顺序为c、b、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42﹣)
⑤亚磷酸(H3PO3)是二元弱酸,所以Na2HPO3稀溶液一定呈碱性
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7.
⑦某二元酸在水中的电离方程式是H2B═H++HB﹣;HB﹣H++B2﹣ , 则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
(6)25℃时Ksp[Mg(OH)2]=5.6×10﹣12 , Ksp[Cu(OH)2]=2.2×10﹣20 , Ksp[Fe(OH)3]=4.0×10﹣38 , Ksp[Al(OH)3]=1,.1×10﹣33 . 在25℃下,向浓度均为0.1molL﹣1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式).现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2molL﹣1 . 此时所得沉淀中(填“还含有”或“不含有”)Al(OH)3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol/L、100mL的Ba(OH)2溶液中,分别滴入浓度均为0.1mol/L的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。
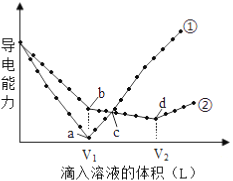
(1) 0.1mol/L的NaHSO4溶液pH=_____________。
(2)曲线___________代表滴加H2SO4溶液的变化曲线。b点溶液的酸碱性为___________(酸性或碱性或中性)。
(3)d点溶液中主要离子种类:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成医用麻醉药苄佐卡因E和食品防腐剂J的路线如图所示:
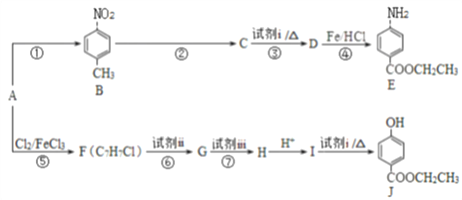
已知:
请回答下列问题:
(1)A属于芳香烃,结构简式为_____________。
(2)E中官能团的名称是氨基、____________。
(3)C能与NaHCO3溶液反应,反应③的化学方程式是___________。
(4)反应⑥、⑦中试剂ii和试剂iii依次是 ___________、___________。
(5)反应①~⑦中,属于取代反应的是_______________。
(6)J有多种同分异构体,其中符合下列条件的同分异构体有______________种,写出其中任一种同分异构体的结构简式:___________。
a. 为苯的二元取代物,其中一个取代基为羟基
b. 属于酯类,且能发生银镜反应
(7)以A为起始原料,选用必要的无机试剂合成高分子树脂(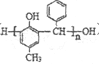 ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_______________。
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0L恒容密闭容器中充入2mol SO2和1mol O2 , 发生反应: 2SO2(g)+O2(g)2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前t1 s 的平均速率v(O2)= ![]() ?mol?L﹣1?s﹣1
?mol?L﹣1?s﹣1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.相同温度下,起始时向容器中充入4mol SO3 , 达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2mol SO2、1mol O2 , 反应达到新平衡时 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质,所用试剂和方法正确的是( )
选项 | 物质 | 杂质 | 除杂质所用试剂和方法 |
A | KCl溶液 | I2 | 蒸馏 |
B | KNO3 | K2SO4 | BaCl2溶液,过滤 |
C | Cu | CuO | 稀硫酸,过滤 |
D | CaCO3 | Ca(OH)2 | 盐酸,过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Na2SO3固体与硫酸可发生反应:Na2SO3+ H2SO4=Na2SO4+H2O+SO2↑,下图是实验室制取SO2并验证SO2的某些性质的装置图。回答正确的是( )

A. ①中的实验现象为紫色石蕊试液褪色此实验证明SO2具有漂白性
B. ③中溶液变浑浊是因为SO2和H2S发生了氧化还原反应,氧化产物和还原产物质量比为1∶1
C. ④和②中溶液均褪色,但褪色的原理不同
D. 实验室中可以用澄清石灰水代替氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
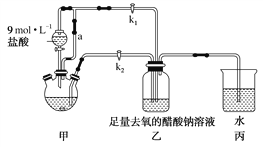
①检查装置气密性,往三颈烧瓶中依次加入过量锌粉、适量CrCl3溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到2.76 g[Cr(CH3COO)2]2·2H2O。
(1)装置甲中连通管a的作用是______________________。
(2)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为______________________。
(3)实验步骤③中溶液自动转移至装置乙中的实验操作为______________________。
(4)装置丙中导管口水封的目的是______________________。
(5)洗涤产品时,为了去除可溶性杂质和水分,下列试剂的正确使用顺序是________(填字母)。
a.乙醚 b.去氧冷的蒸馏水 c.无水乙醇
(6)若实验所取用的CrCl3溶液中含溶质3.17 g,则[Cr(CH3COO)2]2·2H2O(相对分子质量为376)的产率是______________________。
(7)一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com