
【题目】一种高容量的固态锂电池以锂超离子固态导体(组成为Li30GeP2S12)为电解质,该锂电池能在﹣100℃至100℃之间的超宽温度范围内工作.下列说法不正确的是( )
A.Li的原子结构示意图为 ![]()
B.原子半径:P>S
C.酸性:H3PO4<H2SO4
D.Li、Ge、P、S都属于短周期元素
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组模拟工业流程制备无水FeCl3 , 再用副产品FeCl3溶液吸收有毒的H2S.
【查阅资料】经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.
【设计方案】学习小组设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: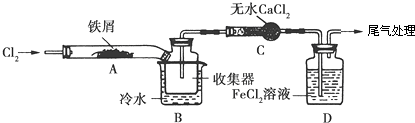
①检验装置的气密性;②通入干燥的Cl2 , 赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;④…;⑤体系冷却后,停止通入Cl2 , 并用干燥的N2赶尽Cl2 , 将收集器密封.
请回答下列问题:
(1)Fe元素的原子结构示意图为 . FeCl3是化合物(填“离子”或“共价”).
(2)装置A中反应的化学方程式为 .
(3)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是 .
(4)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) .
(5)装置B中冷水浴的作用为;装置C的名称为;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂K3[Fe(CN)6]是配位化合物,其配位数为 , 配体为
(6)该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;FeCl3与H2S反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是过氧化氢(H2O2)分子的空间结构示意图。
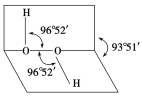
(1)写出过氧化氢分子的电子式________。
(2)下列关于过氧化氢的说法中正确的是(填序号)______________。
①分子中有极性键 ②分子中有非极性键 ③氧原子的轨道发生了sp2杂化 ④O—O共价键是p—pσ键 ⑤分子是非极性分子
(3)过氧化氢分子之间易形成氢键,该氢键的表示式是____________。
(4)过氧化氢难溶于二硫化碳,主要原因是_________________;过氧化氢易溶于水,主要原因是_________________。
(5)过氧乙酸也是一种过氧化物,它可以看作是过氧化氢分子中的一个氢原子被乙酰基(CH3CO)取代的产物,是一种常用的杀菌消毒剂。在酸性条件下过氧乙酸易发生水解反应生成过氧化氢。
①写出过氧乙酸发生水解反应的化学方程式(有机物用结构简式表示):________________________。
②过氧乙酸用作杀菌消毒剂的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮肥的说法正确的是( )
A.硫铵与石灰混用肥效增强
B.所有铵态氮肥中,氮元素化合价都是 3 价
C.使用碳铵应深施盖土
D.尿素属于氨态氮肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH﹣)增大
B.将NaOH和氨水溶液各稀释一倍,两者的OH﹣浓度均减少到原来的 ![]()
C.相同浓度的HCl和CH3COOH,两溶液中c(H+)相同
D.甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的中c(H+)之比为10:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50mL 0.50molL﹣1的盐酸与50mL 0.55molL﹣1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应 过程中所放出的热量计算中和热.下列说法中,正确的是( ) 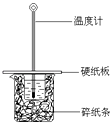
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若烧杯上不盖硬纸板,测得的△H将偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物.它可由氟碳酸铈精矿经如图1流程制得. 
(1)如图2是一种稀土元素铈(Ce)在元素周期表中的信息示意图.则铈原子的质子数是 , 氟碳酸铈的化学式为CeFCO3 , 该化合物中,Ce的化合价为;
(2)焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为;
(3)试剂X;
(4)已知298K时,Ksp[Ce(OH)4]=1×10﹣29 , Ce(OH)4的溶度积表达式为Ksp=;为了使溶液中Ce4+沉淀完全,需调节pH为以上;
(5)取某Ce(OH)4产品1.00g(质量分数为97%),加硫酸溶解后,用0.1000molL﹣1的FeSO4溶液滴定至终点(铈被还原成Ce3+)则需要滴加标准溶液的体积mL,若用硫酸酸化后改用0.1000molL﹣1的FeCl2溶液滴定产品从而测定Ce(OH)4产品的质量分数,其它操作都正确,则测定的Ce(OH)4产品的质量分数(填“偏高”、“偏低”或“不变”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com