
常温下,向10 mL o.1 mol/L的HR溶液中逐滴滴人0.l mol/L的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是
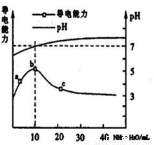
A.a~b点导电能力增强说明HR为弱酸
B.b点溶液pH =7说明NH4R没有水解 。
C.c点溶液存在c( NH4+)>c( R-)、c(OH-)>c(H+)
D.b~e任意点溶液均有c(H+)×c(OH-)= Kw =l. 0×l0-14
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源:2014-2015学年湖南省怀化市高三学业水平模拟考试化学试卷(解析版) 题型:选择题
下列实验方法能达到实验目的的是
A.用淀粉溶液检验溶液中是否存在碘单质
B.用分液漏斗分离水与乙醇的混合物
C.用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液
D.用排水集气法收集氨气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东高考佛山市高三二模理综化学试卷(解析版) 题型:简答题
由钛铁矿(主要成分是TiO2、少量FeO和Fe2O3)制备TiCl4、绿矾等产品的一种综合工艺流程图如下:
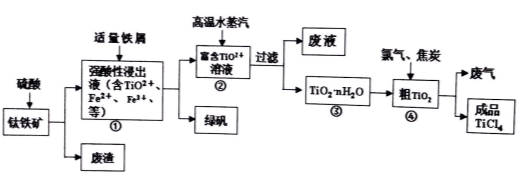
【提示】TiO2+的水解平衡TiO2++(n+1)H2O TiO2.n H2O+2H+
TiO2.n H2O+2H+
回答下列问题:
(1)硫酸与二氧化钛反应的离子方程式是 。
(2)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH = +140 kJ·mol-1
2C(s)+ O2(g)=2CO(g) ΔH = -221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4 和CO气体的热化学方程式: 。
(3)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
A:2Fe3++Fe=3Fe2+
B:2 TiO2+(无色) +Fe+4H+=2Ti3+(紫色)+ Fe2++2H2O
C:Ti3+(紫色)+ Fe3++H2O=TiO2+(无色) +Fe2++2H+
I.结合信息判断Fe3+ 、TiO2+、 H+氧化性强弱: > >
II.加入铁屑的作用是 。
(4)往②中不断通入高温水蒸气,维持溶液沸腾一段时间,析出水合二氧化钛沉淀。
请用化学平衡理论分析通入高温水蒸气的作用: 。
(5)依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)绿矾(摩尔质量为278g/mol)可用于生产红色颜料(Fe2O3),556akg绿矾,理论上可生产红色颜料___mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市高三4月模拟考理综化学试卷(解析版) 题型:选择题
现有含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH溶液的物质的量与生成沉淀的物质的量的关系正确的是(离子形成沉淀或沉淀的溶解与溶液pH的关系如下表)
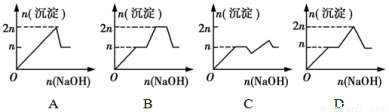
离子 | Mg2+ | Al 3+ | 物质 | Al(OH)3 |
开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市第三次诊断化学试卷(解析版) 题型:简答题
(16分)工业上硫酸锰铵[(NH4)2Mn(SO4)2]可用于木材防火涂料等。其制备工艺如下: 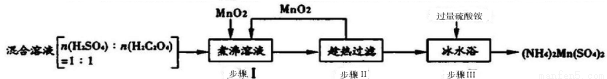
已知步骤Ⅰ反应:H2C2O4(aq) +H2SO4(aq) +MnO2(s) MnSO4(aq)+2CO2(g)+2H2O(1) △H
MnSO4(aq)+2CO2(g)+2H2O(1) △H
(1)在步骤I的反应中,氧化剂是 。
(2)步骤Ⅱ中趁热过滤前需向MnSO4溶液中加入少量热水,其目的是____;步骤III所得(NH4)2Mn(SO4)2:晶体需用酒精溶液洗涤,洗去的主要杂质离子有____ 。
(3)下列操作有利于提高产品产率的是____(填序号)。
A.慢慢分次加入二氧化锰 B.趁热过滤
C.冰水浴充分冷却 D.用水代替酒精溶液洗涤
(4)一定条件下,在步骤I的水溶液中l mol MnO2完全反应相相对能量变化如图。则△H=____;催化剂是否参加化学反应? (填“是”或“否”或“不确定”)。

(5)碱性干电池中含大量MnO2可以回收利用,该电池工作时的正极反应式为____ ;若从干电池中回收87 kg MnO2,理论上可以获得(NH4)2Mn( S04)2 _kg。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市第三次诊断化学试卷(解析版) 题型:选择题
下列应用中,主要利用物质氧化性的是
A.用烟道气中和碱性废水 B.重铬酸钾用于酒驾检查
C.用苯酚制造酚醛树脂 D.金属加工前用硫酸酸洗
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
(原创)某有机物的结构简式如图所示,关于该有机物的说法不正确的是
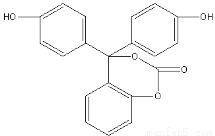
A.该有机物的化学式为C20H14O5
B.该有机物分子中的三个苯环不可能共平面
C.该有机物可发生加成、取代、氧化、消去等反应
D.1mol该有机物与足量NaOH 溶液充分反应,消耗NaOH的物质的量为5 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三四月考化学试卷(解析版) 题型:实验题
(16分)实验室用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)〔Fe(OH)(SO4)〕n和绿矾(FeSO4·7H2O),过程如下:
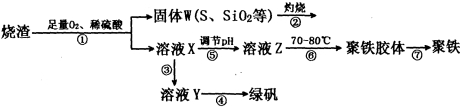
(1)在①中已知FeS中铁元素生成Fe3+,S元素生成单质硫,写出FeS、O2、H2SO4反应的离子方程式______________________________________;
(2)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是___________(填编号);
A.品红溶液 B.酸性KMnO4溶液
C.紫色石蕊溶液 D.溴水
(3)在③中,需加入的物质是___________________________;
(4)在④中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有___________________________;
(5)在⑥中,将溶液Z控制到70~80℃的目的是____________________________________;
(6)为测量聚铁样品中铁元素的质量分数,进行下列实验(假设杂质中不含铁元素和硫元素):称取一定质量样品,将样品溶于足量的_________后(填化学式,下同),滴加过量的__________,产生不溶于酸的沉淀,过滤、洗涤、干燥,称量固体的质量来计算该聚铁样品中铁元素的质量分数。
(7)若用步骤③④制取绿矾,测定3g烧渣中氧化铁的质量分数
①取所得绿矾产品,溶解,配制成1000mL溶液;量取25.00mL待测溶液于锥形瓶中,配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需 。
②用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为15.00mL。判断此滴定实验达到终点的方法是 ;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果 (填“偏高”“偏低”“无影响”)。
③计算烧渣中铁元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:选择题
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com