
| A. | 任何状况下,78克过氧化钠的分子数为NA | |
| B. | 标况下,22.4L氯气在任何反应中转移电子数均为2NA | |
| C. | 标况下,22.4L水中含水分子为NA | |
| D. | 含NA个Na+的Na2O溶解于水配成1L溶液中,Na+的物质的量浓度为1mol•L-1 |
分析 A、过氧化钠是离子晶体;
B、求出氯气的物质的量,然后根据反应后氯元素的价态可能为-1价或+1价或+3价或+5价或+7价来分析;
C、标况下水为液态;
D、NA个Na+的Na2O溶解于水水后,钠离子的个数守恒.
解答 解:A、过氧化钠是离子晶体,故过氧化钠中无分子,故A错误;
B、标况下22.4L氯气的物质的量为1mol,而反应后氯元素的价态可能为-1价或+1价或+3价或+5价或+7价,故转移的电子数无法确定,故B错误;
C、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量和分子数目,故C错误;
D、NA个Na+的Na2O溶解于水水后,钠离子的个数守恒,故溶液中的钠离子的物质的量浓度c=$\frac{\frac{{N}_{A}}{{N}_{A}/mol}}{1L}$=1mol/L,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ca2+)、c(OH-)均增 | B. | c(Ca2+)、c(OH-)均保持不变 | ||
| C. | c(Ca2+)、c(OH-)均减小 | D. | 溶液质量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的密度都比水小 | |
| B. | 碱金属单质都是还原剂 | |
| C. | 碱金属单质的熔沸点一般随着原子的电子层数的增多而升高 | |
| D. | 碱金属单质在氧气中燃烧,产物都是过氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
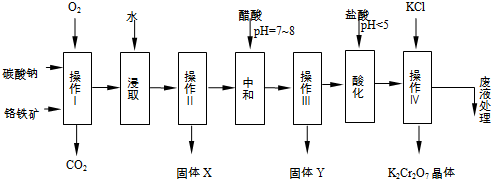
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CuSO4[Cu(OH)2] | B. | NaOH[NaOH] | C. | CuCl2[CuCl2] | D. | NaCl[NaCl] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com