
����Ŀ����֪�����������ȵ�����ͭ��Ӧ�õ������ͽ���ͭ������ͼ�е�װ�ã�ʡ�Լг�װ�ü�����װ�ã�����ʵ�ָ÷�Ӧ��ʵ��ʱC�з�ĩ��Ϊ��ɫ��D�г�����ɫҺ�塣�����й�˵����ȷ���� ( )

A.�Թ�A�м�����Լ�ΪNH4Cl����
B.��Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ2 : 3
C.װ��B�м�������ʿ����Ǽ�ʯ�һ���ˮ�Ȼ���
D.װ��D��Һ�����ʹ����ĺ�ɫʯ����ֽ����
���𰸡�D
��������
��ͼ��֪��A�з���![]() ��BΪ���ﰱ����C�з���
��BΪ���ﰱ����C�з���![]() ��D����ȴ����Һ��Ϊˮ�Ͱ�������E���ռ�������
��D����ȴ����Һ��Ϊˮ�Ͱ�������E���ռ�������
A.ʵ������ȡ����Ӧ���ü����Ȼ�狀��������ƹ���ķ�������ֻ�����Ȼ�粒��岻�ܵõ�������A����
B.![]() Ϊ������ԭ��Ӧ��
Ϊ������ԭ��Ӧ��![]() Ϊ������������Ϊ��ԭ�������������ͻ�ԭ�������ʵ���֮��Ϊ3:2��B����
Ϊ������������Ϊ��ԭ�������������ͻ�ԭ�������ʵ���֮��Ϊ3:2��B����
C.װ��B������Ϊ���ﰱ������������ʿ����Ǽ�ʯ�ң���������ˮ�Ȼ��ƣ����백���������������C����
D. D����ȴ����Һ��Ϊˮ�Ͱ���������Һ�Լ��ԣ���D��Һ�����ʹ����ĺ�ɫʯ����ֽ������D��ȷ��
��ѡD��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ĺ̶��Ǽ���������ѧ��һֱ�о��Ŀ��⡣
��1���±��о��˲�ͬ�¶��´����̵���ҵ�̵��IJ���Kֵ��
��Ӧ | �����̵� N2��g����O2��g�� | ��ҵ�̵� N2��g����3H2��g�� | |||
�¶�/�� | 27 | 2000 | 25 | 400 | 450 |
K | 3.8��10��31 | 0.1 | 5��108 | 0.507 | 0.152 |
���������ݿ�֪�������̵���Ӧ����_____��������������������������Ӧ��
���������ݿ�֪������ʺϴ��ģģ������̵���ԭ��__________________________��
��2����ҵ�̵���Ӧ�У�������������ͬʱ���ֱ�ⶨN2��ƽ��ת�����ڲ�ͬѹǿ��P1��P2�������¶ȱ仯�����ߣ���ͼ��ʾ��ͼʾ�У���ȷ����___������A������B�������Ƚ�P1��P2�Ĵ�С��ϵ��P1______P2(������������� ����)��

���� Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2��g��+3H2��g��![]() 2NH3��g��
2NH3��g��
��3����һ���¶��£���1mol N2��3mol H2����������������ܱ������з�����Ӧ���ﵽƽ��״̬ʱ��������������ʵ���Ϊ2.8mol����ƽ��ʱ��H2��ת������1��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����c(CH3COOH)+c(CH3COO-)=0.1mol��L-1��һ����ᡢ�����ƻ����Һ����Һ��c(CH3COOH)��c(CH3COO-)��pH�Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ����������ȷ���ǣ� ��
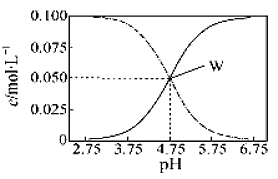
A.pH=5.5����Һ�У�c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B.W������ʾ����Һ�У�c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5����Һ�У�c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol��L-1
D.��W������ʾ��1.0L��Һ��ͨ��0.05molHCl���壨������Һ����仯����c(H+)=c(CH3COOH)+c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������Ħ���棬���ӽṹ��ͼ��ʾ�������й���������˵����ȷ���ǣ� ��

A. ����������Ԫ�صĻ��ϼ�Ϊ+3
B. 22 g P4S3����ԭ����ĿԼΪ1.806��1023
C. �����ʷ��ӽṹ��S��P��������������Ϊ8
D. �����ʷ�����ȫ�Ǽ��Թ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I�����ݱ�����Ϣ����ش��������⣺
��ѧ��Ӧ | ƽ�ⳣ�� | �¶� | |
973K | 1173K | ||
��Fe(s)��CO2(g) | K1 | 1.47 | 2.15 |
��Fe(s)��H2O(g) | K2 | 2.38 | 1.67 |
��CO(g)��H2O(g) | K3 | �� | �� |
(1)��Ӧ����________(��������������������)��Ӧ��
(2)д����Ӧ�۵�ƽ�ⳣ��K3�ı���ʽ_______________________��
(3)���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3��________(��K1��K2��ʾ)��
(4)Ҫʹ��Ӧ����һ�������½�����ƽ�����淴Ӧ�����ƶ����ɲ�ȡ�Ĵ�ʩ��____(��д��ĸ���)��
A����С��Ӧ�������ݻ�B������Ӧ�������ݻ�
C�������¶�D��ʹ�ú��ʵĴ���
E���跨��Сƽ����ϵ�е�COŨ��
(5)����Ӧ�۵��淴Ӧ������ʱ��Ĺ�ϵ��ͼ��ʾ��

�ٿɼ���Ӧ��t1��t3��t7ʱ���ﵽ��ƽ�⣬��t2��t8ʱ���ı���һ�����������жϸı����ʲô������t2ʱ________��t8ʱ________��
����t4ʱ��ѹ��t6ʱ����Ӧ���Ũ�ȣ�����ͼ�л���t4��t6ʱ�淴Ӧ������ʱ��Ĺ�ϵ���ߡ�__________
����25����1.01��105Paʱ��16gҺ̬�״�(CH3OH)��ȫȼ�գ����ָ���ԭ״̬ʱ���ų�363.3kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϻ�������ij�Ͻ���ϣ���Ҫ��Fe��Cu��Co��Li�ȣ���֪Co��Fe�����еȻ��ý������Ĺ����������£�
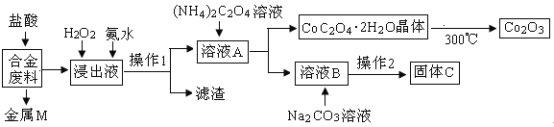
��1������MΪ__________������1Ϊ___________��
��2������H2O2�������ǣ������ӷ���ʽ��ʾ��________�����백ˮ��������________��
��3����ֱ��յĻ�ѧ����ʽΪ____________��
��4����֪Li2CO3����ˮ���䱥����Һ��Ũ�����¶ȹ�ϵ���±�������2�У�����Ũ���������ȹ��ˣ���ԭ����___________��90��ʱKsp��Li2CO3����ֵΪ___________��
�¶�/�� | 10 | 30 | 60 | 90 |
Ũ��/molL��1 | 0.21 | 0.17 | 0.14 | 0.10 |
��5���ö��Ե缫�������Li2CO3��ȡﮣ����������������壬�������ĵ缫��ӦʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ������ɫ�ļ�Ӳ���������Ĺ�ҵ��;�ܹ㣬��Ҫ�н����ӹ�����ơ��Ƹ���ҵ����Щ��ҵ�ŷŵķ�ˮ�ͷ����ǻ����е���Ҫ��ȾԴ����ش���������йص�һЩ���⡣
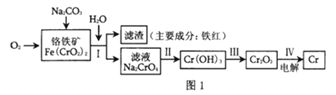
(1)��ҵ��ұ��������Ҫ������ͼ1��ʾ��
����֪�����ķ�Ӧ����ʽΪ��8Na2CrO4+6Na2S+23H2O=8Cr(OH)3��+3Na2S2O3+22NaOH���÷�Ӧ����������___(�ѧʽ)������1molCr(OH)3ʱת�Ƶ��ӵ����ʵ���Ϊ___mol��
�ڲ���IV�е��Cr2O3��������ӦʽΪ___��
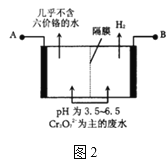
(2)ij�������õ�ⷨ����������ˮ�������������������������������ʢ�ź�����ˮ��ԭ��ʾ��ͼ��ͼ2��AΪ��Դ��___(������������������)����������Һ�з�����������ԭ��ӦΪ___��
(3)��ѧ������(COD)������ˮ�����л�����Ⱦ�ij̶ȡ�������ǿ�Ტ���������£���K2Cr2O7��ǿ����������ˮ��ʱ�����ĵ�K2Cr2O7������������൱��O2�ĺ���(��mg/L��)��ij�о���ѧϰС��ⶨijˮ���Ļ�ѧ������(COD)���������£�
��.ȡVamLˮ������ƿ������10.00mL0.2500mol/L K2Cr2O7��Һ��
��.�����Ƭ������Ȼ�����������������ᣬ��Ͼ��ȣ����ȣ�
��.��Ӧ��Ϻ���ȴ����ָʾ������cmol/L�����������(NH4)2Fe(SO4)2��Һ�ζ����յ�ʱ���������������ҺVbmL(�˲�������Ŀ������Fe2+�Ѷ����Cr2O72-��Ӧ��Cr3+)��
�٢��У���ȡK2Cr2O7��Һ��������___��
�ڢ��У����Ƭ��������___��
�۸�ˮ���Ļ�ѧ������COD=___(�ú�c��Va��Vb�ı���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ�����Ṥҵ�������������̴���Ϊ��
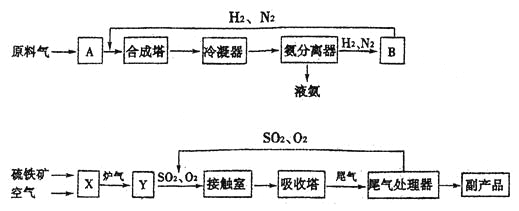
�ϳ����ͽӴ����еķ�Ӧ�ֱ�Ϊ��N2(g)+3H2(g)![]() 2NH3(g) ��H��0�� 2SO2(g)+O2(g)
2NH3(g) ��H��0�� 2SO2(g)+O2(g)![]() 2SO3(g) ��H��0
2SO3(g) ��H��0
��1��д���������豸�����ƣ�B____________��X___________��
��2������ϳ����ͽӴ����е����嶼Ҫ�����ȴ�������������ȴ���������_________________��
��3������ѭ�����������ԭ�ϵ������ʣ����������У�����ѭ����������____________������ţ���
�����Ṥҵ �ںϳɰ���ҵ �����Ṥҵ
��4����ҵ�ϳ���98.3����Ũ��������SO3������ϡ�����ˮ��ԭ����_______________________��
��5����ҵ�����г��ð������ᷨ����β�������Դﵽ������Ⱦ���������õ�Ŀ�ġ����Ṥҵβ���е�SO2���������Եõ�һ�ֻ��ʣ��÷��ϵĻ�ѧʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
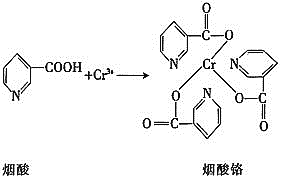
����Ŀ��̹ɣʯ��һ�����繫�ϵ����˱�ʯ�����ֱ�ʯ��1967���״��ڳ��ѩɽ���µİ�³ɳ���������֡�̹ɣʯ����Ҫ��ѧ�ɷ�Ϊ![]() �����ɺ���V��Cr��Mn��Ԫ�ء�
�����ɺ���V��Cr��Mn��Ԫ�ء�
![]() ����״̬�����У�����������һ��������������������________
����״̬�����У�����������һ��������������������________![]() �����
�����![]() ��
��
��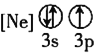 ��
��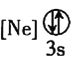 ��
��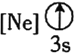 ��
��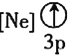
![]() ������Ǹ���һ�ֻ������ϳɹ������£�
������Ǹ���һ�ֻ������ϳɹ������£�
![]() ��������Ų�ʽΪ________��
��������Ų�ʽΪ________��
![]() ��C��N��O�ĵ縺���ɴ�С��˳����_________��
��C��N��O�ĵ縺���ɴ�С��˳����_________��
![]() ������̼����ԭ�ӵ��ӻ���ʽ�ֱ�Ϊ________��________��
������̼����ԭ�ӵ��ӻ���ʽ�ֱ�Ϊ________��________��
![]() �����еĴ�
�����еĴ�![]() �����÷���
�����÷���![]() ��ʾ������m���������γɴ�
��ʾ������m���������γɴ�![]() ����ԭ������n���������γɴ�
����ԭ������n���������γɴ�![]() ���ĵ�����
���ĵ�����![]() �������̼�����еĴ�
�������̼�����еĴ�![]() ���ɱ�ʾΪ
���ɱ�ʾΪ![]() ���������еĴ�
���������еĴ�![]() ��Ӧ��ʾΪ___________��
��Ӧ��ʾΪ___________��
![]() ��
��![]() ������ˮ�⡣
������ˮ�⡣![]() ��
��![]() ������______
������______![]() ���������������Ǽ�����
���������������Ǽ�����![]() ���ӣ����۵�Ĺ�ϵΪ
���ӣ����۵�Ĺ�ϵΪ![]() ________
________![]() ����
����![]() ����
����![]() ������
������![]() ��
��![]() ��
��
![]() ��Mn����GaAs����
��Mn����GaAs����![]() ͼ��
ͼ��![]() �ɵõ�ϡ���뵼�����
�ɵõ�ϡ���뵼�����![]() ͼ��
ͼ��![]() ��ͼ�ס�ͼ�Ҿ���ṹ���䡣
��ͼ�ס�ͼ�Ҿ���ṹ���䡣
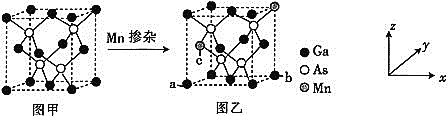
![]() ͼ����a���b���ԭ����������ֱ�Ϊ
ͼ����a���b���ԭ����������ֱ�Ϊ![]() 0��
0��![]() ��
��![]() 1��
1��![]() ����c���ԭ���������Ϊ________��
����c���ԭ���������Ϊ________��
![]() ��ͼ������ܶ�Ϊ
��ͼ������ܶ�Ϊ![]() ����
����![]() ��ʾ�����ӵ���������ֵ����þ����о��������������ԭ��֮��ľ���Ϊ________________pm��
��ʾ�����ӵ���������ֵ����þ����о��������������ԭ��֮��ľ���Ϊ________________pm��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com