
| A、碳酸钠溶液中滴加稀硫酸 |
| B、氯化铁溶液中滴加硫氰化钾溶液 |
| C、碘水中滴加淀粉碘化钾溶液 |
| D、酸性高锰酸钾溶液中滴加亚硫酸钠溶液 |


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
 ,下列说法中正确的是( )
,下列说法中正确的是( )| A、它是苯酚的同系物 |
| B、1 mol该有机物能与溴水反应消耗2 mol Br2发生取代反应 |
| C、1 mol该有机物能与金属钠反应生成0.5 mol H2 |
| D、1 mol该有机物能与2 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 酸性强弱 | 中和后溶液PH值 |
| A | HA>HB | 乙>甲 |
| B | HA>HB | 乙<甲 |
| C | HA<HB | 乙>甲 |
| D | HA<HB | 乙<甲 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、②③④ |
| C、④⑥⑦ | D、③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2HI(g)=H2(g)+I2(g);△H=+11 kJ?mol-1 |
| B、H2(g)+I2(g)=HI(g);△H=-11 kJ?mol-1 |
| C、H2(g)+I2(g)=2HI(g);△H=+288 kJ?mol-1 |
| D、H2(g)+I2(g)=HI(g);△H=-114 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在实验室进行工业合成氨的模拟实验:
在实验室进行工业合成氨的模拟实验:查看答案和解析>>
科目:高中化学 来源: 题型:
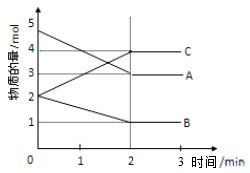 某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析:
某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:
 丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是( )
丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是( )| A、丹参素的分子式为C9H10O5 |
| B、丹参素能发生缩聚、消去、氧化反应 |
| C、1 mol丹参素最多可以和3mol H2发生加成反应 |
| D、1 mol丹参素与足量Na2CO3发生反应最多可生成二氧化碳1.5mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com