
| A. | ①②③④ | B. | ①③④ | C. | ①③ | D. | ②④ |
分析 如果溶液中c(H+)>c(OH-),则该溶液呈酸性,若0.1mol•L-1的NaHA溶液呈酸性,则NaHA溶液中c(H+)>c(OH-),据此分析解答.
解答 解:①稀释时溶液中c(OH-)增大,则溶液中c(H+)减小,说明原来溶液中c(H+)>c(OH-),所以能说明该溶液呈酸性,故正确;
②温度未知,不能根据pH大小判断溶液酸碱性,故错误;
③溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A 2- ),c(Na+)=c(A2-),则 c(H+)>c(OH-),故正确;
④.溶液可与等体积等物质的量浓度的NaOH溶液恰好反应,说明该物质为酸式盐,但不能说明溶液中c(H+)、c(OH-),相对大小,所以不能说明原溶液呈酸性,故错误;
故选C.
点评 本题考查了溶液酸碱性的判断,根据溶液中氢离子和氢氧根离子浓度相对大小判断,易错选项是②,注意不能根据溶液的pH判断溶液酸碱性,如100℃时,水的pH=6,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) | |
| B. | 将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸需加的水量多 | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) | |
| D. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的酯化、丙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 | |
| B. | C8H10含苯环的烃的同分异构体有3种 | |
| C. | 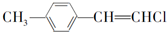 分子中的所有原子不可能共平面 分子中的所有原子不可能共平面 | |
| D. | 莽草酸(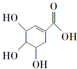 )能与溴水发生取代反应而褪色 )能与溴水发生取代反应而褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用漂白粉可以净化饮用水 | |
| B. | 铜的金属性比铁弱,所以可用铜罐代替铁罐贮藏浓硝酸 | |
| C. | 合成纤维和光导纤维都是人工合成的有机高分子化合物 | |
| D. | 工业上可用石灰乳对煤燃烧形成的烟气进行脱硫,最终能制得石膏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.533L | B. | 0.267L | C. | 4.0L | D. | 2.0L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80gCuO和Cu2S的混合物含有的Cu原子数一定是NA | |
| B. | 标准状况下,5.6L O2作为氧化剂时转移的电子数一定为NA | |
| C. | 常温常压下,14g C2H4和C3H6混合气体中含有的原子数为3NA | |
| D. | 25℃,1LpH=13的NaOH溶液中含有OH-的数目为 0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com