
| A. | 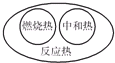 | B. | 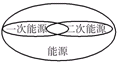 | C. |  | D. | 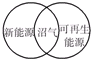 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,反应热是反应过程中能量的变化;
B.一次能源是指直接取自自然界没有经过加工转换的各种能量和资源,它包括:原煤、原油、天然气、油页岩、核能、太阳能、水力、风力、波浪能、潮汐能、地热、生物质能和海洋温差能等等.一次能源可以进一步分为再生能源和非再生能源两大类,由一次能源经过加工转换以后得到的能源产品,称为二次能源,例如:电力、蒸汽、煤气、汽油、柴油、重油、液化石油气、酒精、沼气、氢气和焦炭等;
C.氧化还原反应有的是吸热反应,有的是放热放热;
D.新能源(NE)又称非常规能源,是指传统能源之外的各种能源形式,指刚开始开发利用或正在积极研究、有待推广的能源,如太阳能、地热能、风能、海洋能、生物质能和核聚变能等,可再生能源:是指在自然界中可以不断再生、永续利用的能源,具有取之不尽,用之不竭的特点,主要包括太阳能、风能、水能、生物质能、潮汐能、地热能和海洋能等;
解答 解:A.燃烧热、中和热都是反应热,图示关系正确,故A正确;
B 一次能源与二次能源没有交集,故B错误;
C.氧化还原反应有的是放热反应,如氢气燃烧,也可以是吸热反应,如二氧化碳和碳反应生成一氧化碳,图示符合关系,故C正确;
D.沼气是由植物等发酵而产生的气体,可以说是可再生资源,也可以是新能源,图象关系符合,故D正确;
故选B.
点评 本题考查了常见能源的理解应用、能源种类、掌握基础注意知识积累,题目难度不大.


科目:高中化学 来源: 题型:实验题
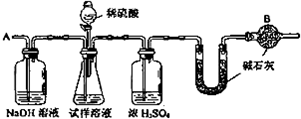
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
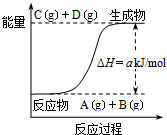
| A. | 该体系的压强不变时标志此反应处于平衡状态 | |
| B. | 若该反应中有电子得失,则可设计成原电池 | |
| C. | 反应物的总键能高于生成物的总键能 | |
| D. | 该反应中的反应物A和B的转化率一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
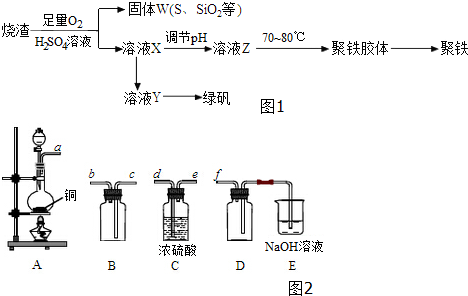
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为92 | B. | 质子数为92 | C. | 电子数为92 | D. | 中子数为92 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于分离酒精和水的混合物 | |
| B. | 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| C. | 装置②中若装满水,收集H2的时候应该从a口通入H2 | |
| D. | 装置①用CCl4萃取碘水中的碘时,CCl4层在下层 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
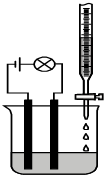 某同学设计了一个测定溶液导电性的实验(如图所示):他先测10.0ml 0.10mol/L H2SO4溶液的导电能力,然后在其中慢慢滴加15.0ml 0.10mol/L Ba(OH)2溶液,并不断搅拌.知溶液中的离子浓度与Ba(OH)2溶液的体积关系如下:
某同学设计了一个测定溶液导电性的实验(如图所示):他先测10.0ml 0.10mol/L H2SO4溶液的导电能力,然后在其中慢慢滴加15.0ml 0.10mol/L Ba(OH)2溶液,并不断搅拌.知溶液中的离子浓度与Ba(OH)2溶液的体积关系如下:| Ba(OH)2(ml) | 溶液中的总离子浓度(mol/L) |
| 0.0 | 0.30 |
| 5.0 | 0.10 |
| 10.0 | ≈0.00 |
| 15.0 | 0.06 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com