
| A. | 18 g H2O含有10NA个质子 | |
| B. | 7.8 g Na2O2中含有的阴离子数是0.2NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
分析 A.水分子中含有10个质子,根据n=$\frac{m}{M}$计算出水的物质的量,再计算出含有质子的物质的量及数目;
B.过氧化钠中含有的阴离子为过氧根离子,0.1mol过氧化钠中含有0.1mol阴离子;
C.标准状况下氨水不是气体;
D.铁与浓硫酸发生钝化,阻止了反应的继续进行.
解答 解:A.18g水的物质的量为:$\frac{18g}{18g/mol}$=1mol,1mol水分子中含有10mol质子,含有10NA个质子,故A正确;
B.7.8 g Na2O2的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,0.1mol过氧化钠中含有0.1mol过氧根离子,含有的阴离子数是0.1NA,故B错误;
C.标准状况下氨水的状态不是气体,不能使用标准状况下的气体摩尔体积计算,故C错误;
D.56 g铁片投入足量浓H2SO4中,发生了钝化现象,无法计算生成二氧化硫的分子数,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标准状况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 电离程度:HCN>HClO | |
| B. | pH:HClO>HCN | |
| C. | 酸根离子浓度:c(CN-)<c(ClO-) | |
| D. | 与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 普通锌锰干电池中的MnO2在工作时起催化作用 | |
| B. | lmol Na2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023 | |
| C. | 室温下,体积、pH均相同的HA和HB两种一元酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA | |
| D. | 恒温恒压密闭容器中反应N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1达到平衡时,向容器中再充入一定量NH3,重新达平衡时a值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
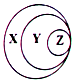
| A. | X-胶体 Y-混合物 Z-淀粉溶液 | B. | X-化合物 Y-含氧酸盐 Z-氯化钠 | ||
| C. | X-气态氢化物 Y-酸 Z-盐酸 | D. | X-强电解质 Y-强酸 Z-硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13:8:27 | B. | 13:9:27 | C. | 26:16:27 | D. | 286:8:27 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
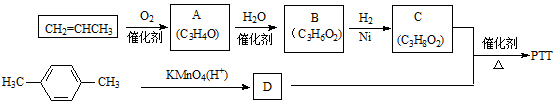

 ,反应类型为
,反应类型为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
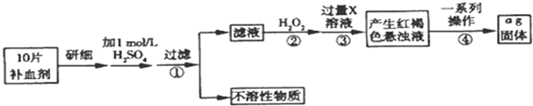
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com