
【题目】乙醇分子结构中,各化学键如图所示。关于乙醇在各种反应中断键的说法不正确的是( )
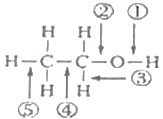
A. 和浓硫酸共热至170℃时,②、⑤键断裂 B. 和金属钠反应时,①键断裂
C. 在银催化条件下与O2反应时,①、③键断裂 D. 乙醇燃烧时,②、④键渐裂
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的有几个
①质子数相同的微粒一定属于同一种元素
②同一元素的核素种数由中子数决定
③Cl2中35C1与37Cl两种核素的个数之比与HCl中35Cl与37C1的个数之比相等
④18 g H2O中含有的中子数为10NA
⑤标准状况下,等体积CH4和HF所含的分子数相同
⑥只有活泼金属元素与活泼非金属元素之间才能形成离子键
⑦等物质的量的CN-和N2含有的共用电子对数相等
⑧通过化学变化可以实现16O与18O之间的相互转化
A. 2个 B. 3个 C. 4个 D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 ;
(4)D最高价氧化物的水化物的化学式为 ;
(5)单质D在充足的单质E中燃烧,反应的化学方程式为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;
(6)单质E与水反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. AlCl3溶液中滴加过量NH3·H2O:Al3+ + 4OH-= AlO2-+ 2H2O
B. 钠与水的反应:Na+2 H2O =Na++2OH-+H2↑
C. NaHSO4溶液中加BaCl2溶液:SO42-+Ba2+=BaSO4↓
D. 氯气与水的反应:Cl2 + H2O = 2 H+ + ClO-+ Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)用乙烯制备聚乙烯:____________________________________;
(2)苯酚稀溶液与过量浓溴水反应:__________________________________;
(3)乙酸乙酯在稀硫酸加热条件下水解:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(3)电化学法是合成氨的一种新方法,其原理如图所示,阴极的电极反应式是_____。

(4)废水中含氮化合物的处理方法有多种。
① NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N2 0.672 L(标准状况),则需要消耗0.3 mol·L-1的NaClO溶液______________L。
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是______________kJ。
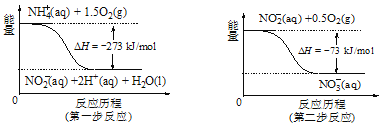
③ 用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH______(填“升高”、“降低”或“不变”)。
(5)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。若某次捕捉后得到pH=10 的溶液,则溶液c(CO32-)∶c(HCO3-)=_______。 [常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(实验题)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)
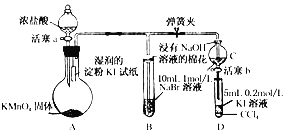
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是____________________
(2)验证氯气的氧化性强于碘的实验现象是____________________
(3)B中溶液发生反应的离子方程式是____________________
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是__________________________________________
(5)过程Ⅲ实验的目的是____________________
(6)氯溴碘单质的氧化性逐渐减弱的原因:同主族元素从上到下_________,得电子能力逐渐减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com