
 N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。该反应为_____________(“放热”“吸热”)反应。
N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。该反应为_____________(“放热”“吸热”)反应。| 化学键 | 键能( kJ·mol-1) | 化学键 | 键能( kJ·mol-1) |
| N≡N | 942 | H—O | 460 |
| N—H | 391 | O==O | 499 |
| H—H | 437 | | |
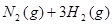
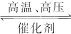
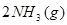
 2NH3(g) ΔH="-93" kJ·mol-1。②H2的燃烧热为:(437 kJ·mol-1+0.5×499 kJ·mol-1-2×460 kJ·mol-1)+44.0 kJ·mol-1="-277.5" kJ·mol-1,则1 g H2完全燃烧时放出的热量为:277.5 kJ·mol-1×0.5 mol="138.8" kJ。由于H2O(g)转化为H2O(l)时放出热量,故H2O(g)的稳定性小于H2O(l)。
2NH3(g) ΔH="-93" kJ·mol-1。②H2的燃烧热为:(437 kJ·mol-1+0.5×499 kJ·mol-1-2×460 kJ·mol-1)+44.0 kJ·mol-1="-277.5" kJ·mol-1,则1 g H2完全燃烧时放出的热量为:277.5 kJ·mol-1×0.5 mol="138.8" kJ。由于H2O(g)转化为H2O(l)时放出热量,故H2O(g)的稳定性小于H2O(l)。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(Q1+Q2)/(2Q1+Q3) | B.(Q1-Q3)/(Q3-2Q1) |
| C.(2Q1+Q2)/2Q3 | D.(2Q1-Q2)/2Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 |
| B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” |
| C.用电解水的方法制取大量氢气可以缓解能源不足的问题 |
| D.由于我国煤和石油的储量十分丰富,所以太阳能和核能的开发在我国并不十分重要 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3c–a-b | B.a+b-3c | C.a+3b-2c | D.a+3b-6c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com