
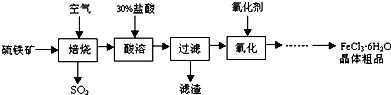
| ||
| ||


科目:高中化学 来源: 题型:
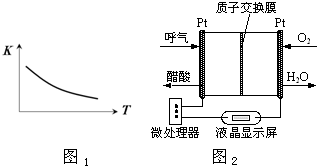 甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景.
甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:
A、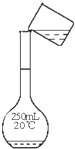 用图所示操作转移NaOH溶液到容量瓶中 |
B、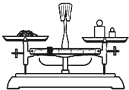 用图所示装置准确称得0.1575gH2C2O4?2H2O固体 |
C、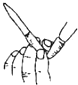 用 用图所示操作排除碱式滴定管中的气泡 |
D、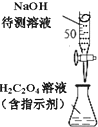 用图所示装置以NaOH待测液滴定H2C2O4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴入石蕊试液显蓝色的溶液中:K+、Na-、HSO3-、ClO- |
| B、0.1mol?L-l的Fe(NO3)2溶液中:Na+、H+、SCN-、I- |
| C、0.1mol?L-l的NaAlO2溶液中:K+、H+、NO3-、SO42- |
| D、由水电离产生的c(H+)=1×10-13mol?L-l的溶液中:Na+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙烯酮(CH2=C=O)是一种重要的有机中间体,可由C2H2和O2的混合气体通过锌、钙、银的三种金属的氧化物(催化剂)反应得到.也可用CH3COOH在痕量(C2H5O)3P=O存在下加热脱H2O得到.
乙烯酮(CH2=C=O)是一种重要的有机中间体,可由C2H2和O2的混合气体通过锌、钙、银的三种金属的氧化物(催化剂)反应得到.也可用CH3COOH在痕量(C2H5O)3P=O存在下加热脱H2O得到.查看答案和解析>>
科目:高中化学 来源: 题型:
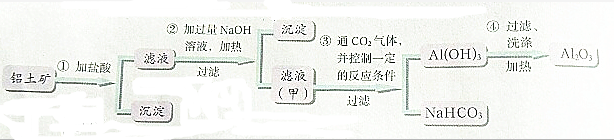
查看答案和解析>>
科目:高中化学 来源: 题型:
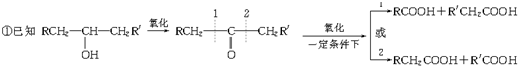
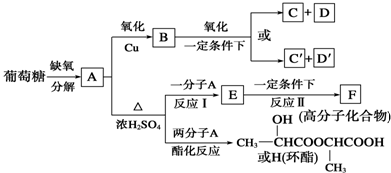
查看答案和解析>>
科目:高中化学 来源: 题型:
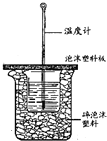 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光导纤维、聚酯纤维、棉花都属于有机高分子化合物 |
| B、在大米酿酒的过程中,淀粉最后变成了单糖 |
| C、“地沟油”经过加工处理后可以用来制肥皂 |
| D、明矾和漂白粉处理自来水,二者的作用原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com