
I.下列实验操作或对实验事实的描述中,正确的是________(填序号)。
①用量筒量取稀硫酸溶液8.0 mL;
②Fe(OH)3胶体与FeCl3溶液的混合物可用过滤的方法分离;
③用湿润的pH试纸测量某溶液pH时,测量值可能比真实值小;
④用碱式滴定管量取KMnO4溶液20.50 mL;
⑤在实验室中用锌和稀硫酸反应制氢气,为加快反应速率而不影响H2的品质,可向溶液中加适量Cu(NO3)2晶体。
Ⅱ.将某98%的浓硫酸样品敞口露置于空气中,放置24 h后,取出5 mL浓硫酸与18 mL 9 mol·L-1的NaOH溶液恰好完全中和。请回答下列问题:
(1)该硫酸样品露置24 h后,其物质的量浓度是___________mol·L-1。
(2)若分别用下列方法鉴别浓硫酸和稀硫酸,可以达到目的的是____________(填序号)。
a.常温下加入铜片 b.常温下加入铁片
c.常温下加入木炭 d.用玻璃棒各蘸取少许涂在滤纸上
(3)工业上利用过量氨水吸收硫酸工业尾气中的有害物质,请写出该过程中发生的一个反应的离子方程式_____________________________________。
【答案】I.①③; Ⅱ.(1)16.2;(2)bd;(3) 或
或
【解析】本题考查化学实验仪器的使用方法,化学实验基本操作,浓硫酸和稀硫酸的性质,酸碱中和滴定。I.①用量筒可以准确量取0.1mL的液体,正确;②胶体与溶液都可以通过滤纸,不能用过滤的方法分离溶液和胶体,错误;③用湿润的pH试纸测量某溶液pH时,如果测的是酸性溶液,相当于稀释了待测溶液,测量值比真实值小,正确;④KMnO4溶液是强氧化剂,应该用酸式滴定管量取,错误;⑤加适量Cu(NO3)2晶体,溶液中含有稀硝酸,有强氧化性,与锌反应生成NO气体,影响氢气的纯度,错误。故选①③。
Ⅱ.(1)该硫酸样品露置24 h后,其物质的量浓度是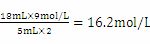 。(2)常温下铜、木炭与浓硫酸和稀硫酸都不发生反应,ac错误;常温下铁遇浓硫酸发生钝化,与稀硫酸反应有气泡产生,b可以鉴别;浓硫酸有脱水性,用玻璃棒蘸取少许涂在滤纸上,一段时间后,蘸浓硫酸的滤纸会变黑,稀硫酸不变黑,d可以鉴别,故选bd。(3)硫酸工业尾气中的有害物质是二氧化硫和三氧化硫,氨水与它们反应分别生成亚硫酸铵和硫酸铵,离子方程式分别是:
。(2)常温下铜、木炭与浓硫酸和稀硫酸都不发生反应,ac错误;常温下铁遇浓硫酸发生钝化,与稀硫酸反应有气泡产生,b可以鉴别;浓硫酸有脱水性,用玻璃棒蘸取少许涂在滤纸上,一段时间后,蘸浓硫酸的滤纸会变黑,稀硫酸不变黑,d可以鉴别,故选bd。(3)硫酸工业尾气中的有害物质是二氧化硫和三氧化硫,氨水与它们反应分别生成亚硫酸铵和硫酸铵,离子方程式分别是: 或
或


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
稀氨水中存在下述电离平衡:NH3+H2O⇌NH3•H2O⇌NH4++OH﹣加入下列物质:请在答题卡上相应空格处填上:正向移动、逆向移动或不移动.
| 加入的物质 | NH4Cl | NH3 | NaOH |
| 平衡移动的方向 | (1) | (2) | (3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀硫酸溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀硫酸溶液中,电流由D→导线→C;
③A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡;
④B、D相连后,同时浸入稀硫酸溶液中,D极发生氧化反应.
据此,判断四种金属的活动性顺序是( )
|
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.14g聚丙烯中含C-H键总数目为2NA
B.1molFe与足量的稀硝酸反应转移电子总数目为2NA
C.标准状况下,44.8L乙醛中含乙醛分子总数目为2NA
D.常温常压下,200g质量分数为17%H2O2溶液中含氧原子总数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。
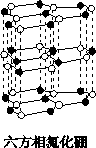
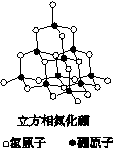
关于这两种晶体的说法,正确的是
| A.立方相氮化硼含有σ键和π键,所以硬度大 | B.六方相氮化硼层间作用力小,所以质地软 |
| C.两种晶体中的既有极性键又有非极性键 | D.两种晶体均为原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为
| A.(a+b)mol | B.(a-b)mol | C.(a-b)mol | D.(a+b)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题:
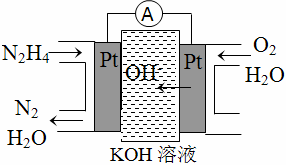
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为____________________________________。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g) 2NO2(g) ΔH=-67.7kJ·mol-1
2NO2(g) ΔH=-67.7kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
2NO2(g) N2O4(g) ΔH=-52.7kJ·mol-1
N2O4(g) ΔH=-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:________________________________________________________________。
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在高锰酸钾催化下,尿素[CO(NH2)2]和次氯酸钠—氢氧化钠溶液反应获得,尿素法反应的离子方程式为_____________________________________________________。
(4)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。
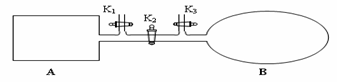
①B中可通过__________________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数________(填 “变大”、“变小”或“不变”)
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
22011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药﹣﹣青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如右图所示,则下列说法正确的是( )

|
| A. | 青蒿素与维生素C一样易溶于水 |
|
| B. | 青蒿素的晶体为分子晶体,其化学式为C16H20O5 |
|
| C. | 青蒿素不能与NaOH溶液反应 |
|
| D. | 青蒿素中含有过氧键,一定条件下有氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com