
【题目】下列关于有机物的说法正确的是
A.分子式为C5H10O2,且属于酯的同分异构体共有9种(不考虑立体异构)
B.环己烯(![]() )分子中的所有碳原子共面
)分子中的所有碳原子共面
C.乙醇和丙三醇互为同系物
D.二环己烷( ![]() )的一氯代物有3种结构(不考虑立体异构)
)的一氯代物有3种结构(不考虑立体异构)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】取1mL 0.1mol·L-1AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1mol·L![]() ):
):
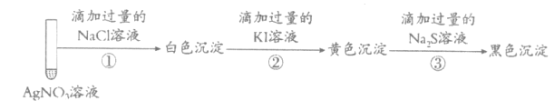
下列说法不正确的是
A.实验①白色沉淀是难溶的AgCl
B.由实验②说明AgI比AgCl更难溶
C.若按①③②顺序实验,看不到黑色沉淀
D.若按②①③顺序实验,看不到白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(p表示压强,T表示温度,n表示物质的量):
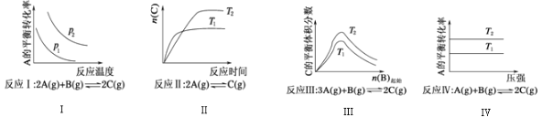
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:△H>0,p2>p1
B.反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1
C.反应Ⅱ:△H>0,T1>T2
D.反应Ⅳ:△H<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.硫酸厂大量排放含SO2的尾气会对环境造成严重危害。
(1)工业上可利用废碱液(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,得到Na2SO3溶液,该反应的离子方程式为______。
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)2CO2(g)的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
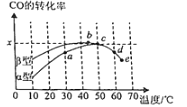
(2)a、b、c、d四点中,达到平衡状态的是______。
(3)已知c点时容器中O2浓度为0.02molL-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=______(用含x的代数式表示)。
(4)观察分析图,回答下列问题:

①CO转化反应的平衡常数K(a)______K(c)。
②在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要______(填“大”、“小”)。
③______点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠
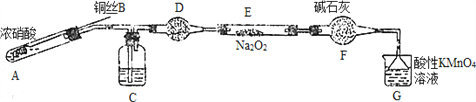
已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
Ⅰ.已知:实验室制乙烯原理为CH3CH2OH![]() CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
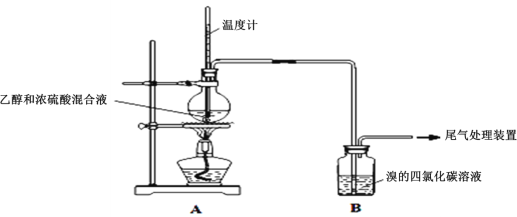
操作 | 现象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有___性。
(2)对产生的气体进行分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①写出实验室制取SO2的化学反应方程式是___;
②乙根据现象认为实验中产生的SO2和___,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)
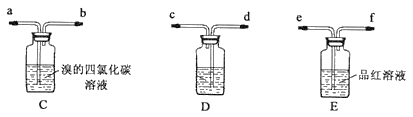
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是___;乙设计的实验D中盛放的试剂是___,装置连接顺序为___ (用仪器接口字母编号)。
b.能说明确实是SO2使E中溶液褪色的实验是___。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是___。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色。
Ⅱ.葡萄酒中常用Na2S2O5做抗氧化剂。
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时溶液中离子浓度由大到小的排列顺序___。
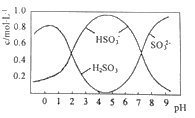
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的工作原理及电池中发生的主要反应如图所示。下列说法错误的是

A. 电池工作时,光能转变为电能,X为电池的负极
B. 镀铂导电玻璃上发生氧化反应生成I-
C. 电解质溶液中发生反应:2Ru3++3I-![]() 2Ru2++I3-
2Ru2++I3-
D. 电池工作时,电解质溶液中I-和I3-的浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、R、D都是周期表中前四周期的元素,它们的原子系数依次增大。其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素。
(1)写出基态D原子的电子排布式__________。
(2)已知高纯度R的单质在现代信息技术与新能源开发中具有极为重要的地位。工业上生产高纯度R的单质过程如下:
![]()
写出过程③的反应方程式___________,已知RHCl3的沸点是31.5oC,则该物质的晶体类型是__________,中心原子的轨道杂化类型为__________,该物质的空间构型是______。
(3)A的第一电离能比B的第一电离能大的原因是_________,A、B两元素分别与R形成的共价键中,极性较强的是________。A、B两元素间能形成多种二元化合物,其中与A3-互为等电子体的物质的化学式为_______。
(4)已知D单质的晶胞如图所示,则晶体中D原子的配位数为______,一个D的晶胞质量为____,已知D原子半径为r pm,则该晶胞的空间利用率为_____________ (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
①二氧化硅可与NaOH溶液反应,因此可用NaOH溶液雕刻玻璃;
② 明矾溶于水可水解生成Al(OH)3胶体,因此可以用明矾对自来水进行杀菌消毒;
③ 可用蒸馏法、电渗析法、离子交换法等对海水进行淡化;
④ 从海带中提取碘只需用到蒸馏水、H2O2溶液和四氯化碳三种试剂;
⑤地沟油可用来制肥皂、提取甘油或者生产生物柴油;
⑥石英玻璃、Na2O·CaO·6SiO2、淀粉、氨水的物质类别依次为纯净物、氧化物、混合物、弱电解质。
A. ③⑤⑥ B. ①④⑤ C. 除②外都正确 D. ③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com