
����1 L������ͨ��CO2��H2��2 mol����һ�������·�����Ӧ��CO2��H2![]() CO��H2O���ش��������⣺
CO��H2O���ش��������⣺
(1)��830�������£���Ӧ�ﵽƽ��ʱCO2��ת����Ϊ50�������������ƽ�ⳣ��K1��________��
(2)��(1)�Ļ����ϣ�����ϵ�¶Ƚ���800�森��֪�������µ�ƽ�ⳣ��K2��0.81��������֪�÷�Ӧ������ӦΪ________��Ӧ(����ȡ��������ȡ�)��
(3)��(1)�Ļ����ϣ�ѹ���������֮0.5 L���������µ�ƽ�ⳣ��ΪK3����K3________K1
(4)T��ʱ��ijʱ�̲����ϵ�и����ʵ������£�n(CO2)��1.2 mol��n(H2)��1.5 mol��
n(CO)��0.9 mol��n(H2O)��0.9 mol�����ʱ�÷�Ӧ________���У�(�������Ӧ�������淴Ӧ������ƽ��״̬��)��
����һ�ݻ�Ϊ1 L���ܱ������м���һ������X��Y��������ѧ��ӦX(g)��2Y( s)![]() 2Z(g)����H��0����ͼ��������X��Z�����ʵ���Ũ����ʱ��仯�����ߣ�
2Z(g)����H��0����ͼ��������X��Z�����ʵ���Ũ����ʱ��仯�����ߣ�
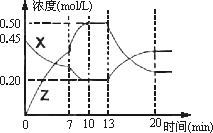
(1)0��10 min�����������ѹǿ��________��(��������С������ȷ����)
(2)�Ʋ��ڵ�7 minʱ���߱仯��ԭ�������________��13 minʱ���߱仯��ԭ�������________(�����)
������Z����
������X����
������
�ܽ���
��ʹ�ô���
 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯�����
H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯�����| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��Kc | 9.94 | 9 | 1 |
| A | B | C | D | E | |
| n��CO2�� | 3 | 1 | 0 | 1 | 1 |
| n��H2�� | 2 | 1 | 0 | 1 | 2 |
| n��CO�� | 1 | 2 | 3 | 0.5 | 3 |
| n��H2O�� | 5 | 2 | 3 | 2 | 1 |
 2CO��g��ƽ�ⳣ��K��
2CO��g��ƽ�ⳣ��K�� CO��g��+H2��g�� ƽ�ⳣ��K1��
CO��g��+H2��g�� ƽ�ⳣ��K1�� H2��g��+CO2��g�� ƽ�ⳣ��K2��
H2��g��+CO2��g�� ƽ�ⳣ��K2��| K1 |
| K2 |
| K1 |
| K2 |
| 4 |
| 9 |
| 4 |
| 9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��Kc | 9.94 | 9 | 1 |
| A | B | C | D | E | |
| n��CO2�� | 3 | 1 | 0 | 1 | 1 |
| n��H2�� | 2 | 1 | 0 | 1 | 2 |
| n��CO�� | 1 | 2 | 3 | 0.5 | 3 |
| n��H2O�� | 5 | 2 | 3 | 2 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡ������ѧ2011��2012ѧ��߶���ѧ�����п��Ի�ѧ���� ���ͣ�022
��1 L������ͨ��CO2��H2��2 mol����һ�������·�����Ӧ��CO2 ��H2![]() CO��H2O���ش����������
CO��H2O���ش����������
(1)��830�������£���Ӧ�ﵽƽ��ʱCO2��ת����Ϊ50����������ϵ�¶Ƚ���800�����ƽ�ⳣ��K1��0.81��������֪�÷�Ӧ������ӦΪ________��Ӧ(����ȡ��������ȡ�)��
(2)T��ʱ��ijʱ�̲����ϵ�и����ʵ������¡�n(CO2)��1.2 mol��n(H2)��1.5 mol��
n(CO)��0.9 mol��n(H2O)��0.9 mol�����ʱ�÷�Ӧ________���У�(�������Ӧ�������淴Ӧ������ƽ��״̬��)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com