
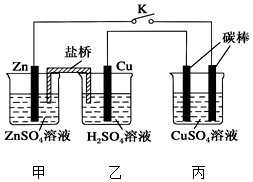
 用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )| A. | 乙烧杯中铜棒为正极,其电极反应式为2H++2e-═H2↑ | |
| B. | 丙烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应时盐桥中的阴离子向甲烧杯移动 | |
| D. | 导线中通过电子的物质的量为0.1 mol |
分析 A、Cu活泼性比Zn弱,作正极;
B、与原电池负极相连为阴极,析出铜单质;
C、盐桥中的阴离子向负极区域移动;
D、2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2 ↑+2H2SO4~4e-,据此计算.
解答 解:A、Cu活泼性比Zn弱,作正极,正极上氢离子得电子生成氢气,则其电极反应式为2H++2e-═H2↑,故A正确;
B、烧杯右侧碳棒与原电池负极相连为阴极,阴极上阳离子得电子,即铜离子得电子析出铜单质,故B正确;
C、反应时盐桥中的阴离子向负极区域移动,即向着甲烧杯移动,故C正确;
D、右侧烧杯中反应为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2 ↑+2H2SO4,加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,则电解生成的铜为0.1mol,转移的电子为0.2mol,故D错误.
故选D.
点评 本题考查了原电池原理和电解池原理的应用,注意根据电子守恒分析,注意把握电极反应式,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧生成氧化钠 | |
| B. | 将钠投入滴有紫色石蕊试液的水中,水溶液变为红色 | |
| C. | 将一小块钠放在CuSO4溶液中发生反应离子方程式:2Na+Cu2+═2Na++Cu | |
| D. | 将4.6gNa投入到95.4g水中,所得溶液中溶质的质量分数大于8.0% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24L O2 | |
| B. | 含NA个氢分子的H2 | |
| C. | 8.5g氨气(氨气的摩尔质量为17g•mol-1) | |
| D. | 含3.01×1022个分子的CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min SO2质量/10-3g 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中滴加Na2CO3溶液,立即产生沉淀和气体 | |
| B. | 若C(Cl-)=0.07mol/L,则溶液的PH为2 | |
| C. | 往溶液中加入NaOH溶液,先生成的沉淀呈红褐色 | |
| D. | 往溶液中通入NH3,直至溶液呈中性,此时溶液中C(NH4+)═C(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com