
���ڹ�����ռ����Ҫ�ĵ�λ�����������̽����
��1��������������ˮ����ͨ�����ȵ�̿������ˮú����
C(s) + H2O(g) ![]() H2(g) + CO(g) ��H = +131.3 kJ ����S = +133.7 J/K
H2(g) + CO(g) ��H = +131.3 kJ ����S = +133.7 J/K
�÷�Ӧ�ڵ������ܷ��Է� ����ܻ��
��2����֪��400��ʱ��N2 (g)+ 3H2(g) ![]() 2NH3(g)��K=0.5,
2NH3(g)��K=0.5,
��2NH3(g)![]() N2 (g)+ 3H2(g)��K= ������ֵ����
N2 (g)+ 3H2(g)��K= ������ֵ����
��400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��ӦV(N2)�� V(N2)���������������������ȷ����
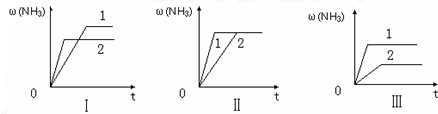
��3����������ͬ�����и�����1 molN2��3molH2����ijһ��ͬ�����·�Ӧ���ﵽƽ�⣬�������������ʱ��仯��������ͼ������˵����ȷ���� ������ţ� ��
A��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P2��P1
B��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P1��P2
C��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1��T2
D��ͼ�������ͬ��ͬѹ�£��������ܣ�1��2
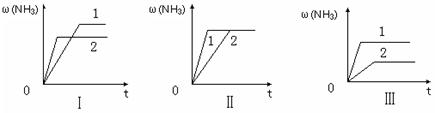
��1����(����)�� ��2��2, =����3��D
��1����H-T��S��0����Ӧ�Է����С�������Ŀ���ݣ�����ʱ��T��С����H-T��S��0����Ӧ�����Է����С� ��2��K=1/0.5=2����ʱN2��H2��NH3�����ʵ���Ũ�ȷֱ�Ϊ4mol/L��2mol/L��4mol/L��C(N2)C(H2)3 /C(NH3)2=2,������ƽ��״̬ ��3������ͼ���������ؼ���һץ�յ㣬�յ�ĺ�����ԽС��˵���ﵽƽ������ʱ��̷�Ӧ���ʿ죬�ɴ��¶ȸߡ�ѹǿ�����ʹ���˴�����һץˮƽ�ߣ�ˮƽ�ߵ�������Խ�����������Խ�ߣ���ӦԽ������С�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| �������� | ���� | ���� | ���� | ���� | ��� | ��� | ��� |
| �е�/�� | -196 | -183 | -269 | -264 | -186 | -153 | -108 |
| ԭ�� | ��Ȼ�� | ���� | ú |
| ���Ͷ�ʷ��� | 1.0 | 1.5 | 2.0 |
| ��������/J?t-1 | 28��109 | 38��109 | 48��109 |
| ||
| ���� |
| ||
| ���� |
| NH3����% ѹǿ/MPa �¶�/�� |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
 2NH3�ġ�H
2NH3�ġ�H| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com