
 某地区使用含较多Ca2+、Mg2+的天然水按下列步骤制取纯净水.
某地区使用含较多Ca2+、Mg2+的天然水按下列步骤制取纯净水.| ①沉降 |
| ②过滤 |
| ③曝气 |
| ④离子交换 |
| ⑤消毒 |


科目:高中化学 来源: 题型:
| A、乙醇稀溶液:K+、Na+、SO42-、OH- | ||
| B、氨水溶液:Mg2+、Ag+、NO3-、CH3COOH | ||
C、
| ||
| D、使石蕊变红的溶液:Fe2+、Al3+、ClO-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点/℃ | 沸点/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁 醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.5 | -6.5 |
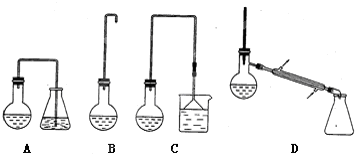
查看答案和解析>>
科目:高中化学 来源: 题型:
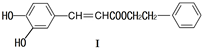

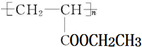 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
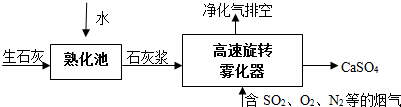
查看答案和解析>>
科目:高中化学 来源: 题型:
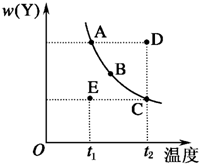 对于2X(g)?Y(g)的反应体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).
对于2X(g)?Y(g)的反应体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、城市采用分质供水,收集雨水进行综合利用 |
| B、推广煤的气化、液化技术,提供清洁高效燃料 |
| C、大力发展汽车产业,鼓励市民购买家用汽车 |
| D、开发利用太阳能、风能、氢能、核能等能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com