
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源:不详 题型:填空题
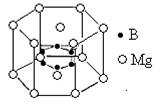
| A.二氧化硅 | B.乙烷晶体 | C.碳酸钠 | D.氯化钠 E.晶体氩F.过氧化氢 G.镁(用字母填空) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
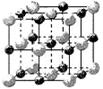
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
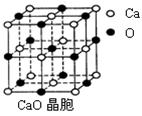
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔点1723 ℃固体不导电,难溶于水和酒精,硬度大 |
| B.熔点1083 ℃固体导电,熔融状态能导电,是电的良导体 |
| C.熔点190 ℃熔融状态不能导电,可溶于水,水溶液能导电 |
| D.熔点1291 ℃固体不导电,熔融状态能导电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
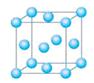
 mol(N2分子中的键能为942kJ/mol),晶体结构如图所示。下列有关高聚氮的说法不正确的是
mol(N2分子中的键能为942kJ/mol),晶体结构如图所示。下列有关高聚氮的说法不正确的是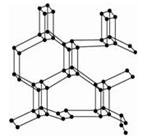
| A.高聚氮晶体属于分子晶体 |
| B.高聚氮晶体中每个N原子和另外3个N原子相连 |
| C.高聚氮转变成氮气是氧化还原反应 |
| D.高聚氮可能成为炸药 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
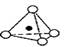 ,其中O表示氧原子,中心黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成各种不同的多聚硅酸根离子。下图为某无限长单链的多聚硅酸根离子:
,其中O表示氧原子,中心黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成各种不同的多聚硅酸根离子。下图为某无限长单链的多聚硅酸根离子: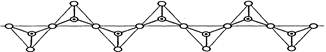
| A.1︰2 | B.1︰3 | C.1︰4 | D.2︰5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com