
| A. | 平衡向正反应方向移动,逆反应速率减小 | |
| B. | 平衡常数K增大 | |
| C. | NO2的转化率变大 | |
| D. | 容器内气体颜色先变深后变浅,最后比原来还要浅 |
分析 在恒容密闭容器中,可逆反应达到平衡后,向容器内再充入1molNO2,容器中气体的物质的量增大则压强增大,平衡向气体体积减小的方向移动;达到平衡时由于二氧化氮浓度比原平衡大,所以混合气体颜色加深,据此进行解答.
解答 解:A.向容器内再充入1molNO2,容器内压强增大,平衡向气体体积减小的正反应方向移动,而逆反应速率开始不变,之后逐渐增大,故A错误;
B.由于温度不变,则该反应的化学平衡常数不变,故B错误;
C.增大压强有利于平衡向正反应方向移动,所以二氧化氮的转化率增大,故C正确;
D.增大反应物浓度平衡向正反应方向移动,再次达到平衡后容器内二氧化氮浓度比第一次平衡时浓度大,所以容器内气体颜色先变深后变浅,最后比原来还要深,故D错误;
故选C.
点评 本题考查了压强对化学平衡的影响,题目难度不大,注意掌握影响化学平衡的因素,D为易错点,注意虽然二氧化氮转化率增大,但平衡时二氧化氮浓度要大于第一次平衡,所以最终颜色要比原来深.


科目:高中化学 来源: 题型:选择题
| A. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| B. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7 Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O | |
| D. | 向NaHCO3 溶液中滴入过量的Ba(OH)2溶液:HCO3-+Ba2++OH-═H2O+BaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与氢气是同素异形体 | B. | 是一种新型化合物 | ||
| C. | 其中含有离子键 | D. | 能被还原成H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可燃冰是一种天然气的水合物,它的开采使用有助于解决温室效应 | |
| B. | 天然食品添加剂比化学合成品安全可靠 | |
| C. | 有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小,有磁性,这种碳与金刚石的关系是同素异形体 | |
| D. | 工业酒精含95%左右的乙醇,可以用于酒精饮料的勾兑,降低生产成本 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
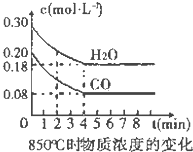 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com