
 如图是部分元素在元素周期表中位置,根据下列要求回答问题:
如图是部分元素在元素周期表中位置,根据下列要求回答问题: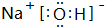 ,故答案为:H3PO4;
,故答案为:H3PO4;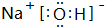 ;
;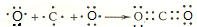 ,
,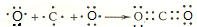 ;
;

科目:高中化学 来源: 题型:
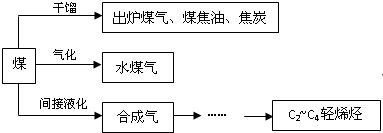
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E均是中学常见的纯净物.其转化关系如图所示(图中某些生成物已略去),物质A与物质B之间的反应不在溶液中进行,通常状况下D为气体.
A、B、C、D、E均是中学常见的纯净物.其转化关系如图所示(图中某些生成物已略去),物质A与物质B之间的反应不在溶液中进行,通常状况下D为气体.查看答案和解析>>
科目:高中化学 来源: 题型:
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3?H2O+H2O |
| B、碘化钾与适量溴水反应:2I-+Br2═I2+2Br- |
| C、硫化钾的水解:S2-+2H2O?H2S+2OH- |
| D、向NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、200mL |
| B、250mL |
| C、425mL |
| D、560mL |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、可用KI淀粉试纸和食醋检验加碘盐中是否含有碘 |
| B、足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O═2HClO3+10HCl |
| C、由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D、途径Ⅱ中若生成1mol I2,反应中转移的电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com