
 的说法,错误的是
的说法,错误的是
| A.是两种原子 | B.互为同位素 |
| C.中子数分别为176和177 | D.电子数相差1 |
科目:高中化学 来源:不详 题型:填空题
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若R2-和M+的电子层结构相同,则原子序数:R>M |
| B.若X、Y都是气态氢化物,且相对分子质量:X>Y,则沸点:X>Y |
| C.若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N |
| D.若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y的强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.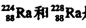 是中子数不同质子数相同的同种核素 是中子数不同质子数相同的同种核素 |
| B.第IA族金属元素是同周期中金属性最强的元素 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.短周期元素形成离子后,最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稳定性:NH3<PH3<SiH4 | B.酸性:HClO4>H2SO4>H3PO4 |
| C.碱性:KOH>NaOH>Mg(OH)2 | D.还原性:F-<Cl-<Br- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子数相等 |
| Y | Y的基态原子最外层电子数是其内层电子总数的2.5倍 |
| Z | Z的基态价电子结构为nsn-1 |
| W | W单质常在火山口附近被发现,其氧化物是造成酸雨的主要原因之一 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素 | 相关信息 |
| X | 啤酒和饮料中常溶有X的最高价氧化物,打开瓶子时,这种氧化物会大量逸出 |
| Y | Y2是空气中含量最高的气体单质 |
| Z | Z的基态原子最外层电子排布式为2s22p4 |
| W | W的一种核素质量数为27,中子数为14 |
 Y2O4(g) △H2=-56.9kJ/mol
Y2O4(g) △H2=-56.9kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:Z>Y>X | B.Z与X在同一周期 |
| C.氢化物的稳定性:X>Y | D.XZ4属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.具有放射性 | B.单质有较高的熔点 |
| C.在化合物中呈+2价 | D.单质的密度小于1 g/cm3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com