
【题目】某化学小组采用类似制乙酸乙酯的装置,用环己醇制备环己烯:
已知: 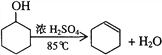
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
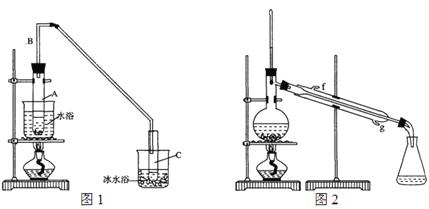
(1)制备粗品:采用如图1所示装置,用环己醇制备环己烯。
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____________,导管B的作用是_______________。
②试管C置于冰水浴中的目的是________________________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量有机酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用________洗涤(填字母)。
A. KMnO4溶液 B. 稀H2SO4 C. Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从____口(填字母)进入。蒸馏时加入生石灰,目的是______________________________________。
③收集产品时,控制的温度应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______(填字母)。
a. 蒸馏时从70℃开始收集产品
b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________(填字母)。
a. 用酸性高锰酸钾溶液
b. 用金属钠
c. 测定沸点
【答案】 防止暴沸 导气,冷凝环己烯 减少环己烯的挥发 上 C g 吸水,生成氢氧化钙,沸点高 83℃ c bc
【解析】(1)①根据制乙烯实验的知识,发生装置A中碎瓷片的作用是防止暴沸,由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝;②冰水浴的目的是降低环己烯蒸气的温度,使其液化减少挥发;(2)①环己烯的密度比水小,在上层;由于分液后环己烯粗品中还含有少量的酸和环己醇,联系制备乙酸乙酯提纯产物时用饱和Na2CO3溶液洗涤可除去酸,答案选C;②蒸馏时冷却水低进高出,即从g口进,原因是冷却水与气体形成逆流,冷凝效果更好,更容易将冷凝管充满水;蒸馏时加入生石灰,目的是吸水,生成氢氧化钙,沸点高。③环己烯的沸点是83℃,则应控制温度为83℃左右;a.蒸馏时从70℃开始收集产品,提前收集,产品中混有杂质,实际产量高于理论产量,a错误;b.环己醇实际用量多了,制取的环己烯的物质的量增大,实验制得的环己烯精品质量高于理论产量,b错误;c.若粗产品中混有环己醇,导致测定消耗的环己醇量增大,制得的环己烯精品质量低于理论产量,c正确;答案选c;(3)区别粗品与精品可加入金属钠,观察是否有气体产生,若无气体,则是精品,另外根据混合物没有固定的沸点,而纯净物有固定的沸点,通过测定环己烯粗品和环己烯精品的沸点,也可判断产品的纯度,答案选bc。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是______。
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
![]()
获取乙二醇的反应历程可分为如下2步:
Ⅰ.
Ⅱ.EC加氢生成乙二醇与甲醇
![]()
① 步骤Ⅱ的热化学方程式是______。
② 研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
反应温度/ ℃ | EC转化率/ % | 产率/ % | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,温度越高,EC的转化率越高,原因是______。温度升高到220 ℃时,乙二醇的产率反而降低,原因是______。
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极a接电源的______极(填“正”或“负”),生成甲醇的电极反应式是______。

(4)CO2较稳定、能量低。为实现CO2的化学利用,下列研究方向合理的是______(填序号)。
a.选择高能量的反应物和CO2反应获得低能量的生成物
b.利用电能、光能或热能活化CO2分子
c.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2RO3是一种二元酸,常温下用1L1mol·L-1Na2RO3溶液吸收RO2气体,溶液的pH随RO2气体的物质的量的变化如图所示。下列说法正确的是
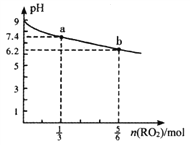
A. a点溶液中2c(Na+)=3c(RO32-)
B. 向b点溶液中加水可使溶液的pH由6.2升高到7.4
C. 常温下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3)
D. 当吸收RO2的溶液呈中性时,c(Na+)=c(RO32-)+c(HRO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸晶体熔点101.5℃;乙二酸晶体加热分解的方程式为:H2C2O42H2O![]() 3H2O + CO2↑+ CO↑。现利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。请回答下列问题:
3H2O + CO2↑+ CO↑。现利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。请回答下列问题:

(1)检验装置A气密性的方法是________________________________________________
(2)A装置是否有误_____________(填“是”或“否”),原因为_______________________
(3)按气流方向连接各仪器,用数字表示接口的连接顺序:①→_________________________;
(4)该套装置有明显缺陷,请予以更正________________________________________________
(5)证明CO存在的实验现象是_________________________________________________;
(6)根据题给的数据,假设反应产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),最终D中生成了两种物质,则这两种生成物的化学式及对应的物质的量分别是①_______________,②_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
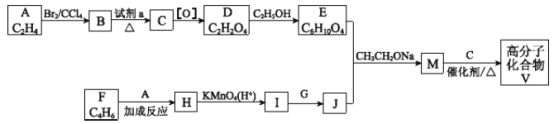
【题目】高分子化合物V (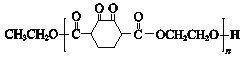 )是人造棉的主要成分之一,合成路线如下:
)是人造棉的主要成分之一,合成路线如下:
已知:I.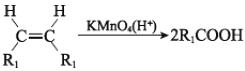
II.![]()
III.
(R、R1、R2、R3 表示烃基)
(1)A的名称是________________________。
(2)试剂a是__________________________。
(3) F与A以物质的量之比1∶1发生反应生成六元环状化合物H,H的结构简式是_______。
(4)I的结构简式是________________________。
(5)G的结构简式是_______________________________;E与J反应生成M的化学方程式是_______________________________________________。
(6)M与C反应生成V的化学方程式是____________________________。
(7)E的同分异构体N也可以和J反应生成M,N可能的结构简式是_______(写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多,其中高压放电法和电解纯水法原理如图所示,下列有关说法不正确的是 ( )
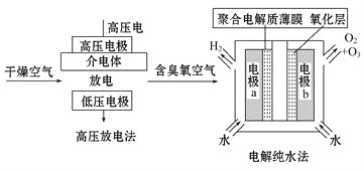
A. 高压放电法,反应的原理为3O2![]() 2O3
2O3
B. 高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C. 电解纯水时,电极b周围发生的电极反应有6OH--6e-=O3↑+3H2O和4OH--4e-=O2↑+2H2O
D. 电解水时,H+由电极a经聚合电解质薄膜流向电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所得溶液中,其物质的量浓度为1.0 mol/L的是( )
A. 将20 g NaOH溶解在500 mL水中
B. 将22.4 L HCl气体溶于水配成1 L溶液
C. 将62.5 g胆矾(CuSO4·5H2O)溶解在适量水中,再加蒸馏水直到溶液的体积为250 mL
D. 将100 mL 10 mol/L的硫酸加入到900 mL水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存,加入OH-能产生沉淀的是( )
A.K+、Mg2+、SO42-、NO3-B.H+、Mg2+、CO32-、S2-
C.Na+、Ca2+、SO42-、Cl-D.MnO4、Cu2+ 、I、H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com