
【题目】欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的的是
A.乙酸乙酯(乙酸):加饱和Na2CO3 溶液,充分振荡静置后,分液
B.乙醇(水):加入新制生石灰,蒸馏
C.乙酸(乙醇):加入金属钠,蒸馏
D.苯(液溴):加入NaOH溶液,分液
科目:高中化学 来源: 题型:
【题目】【合肥市2017届第三次模拟考试】对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。
Ⅰ.CO还原法
(1)一定条件下,由SO2和CO反应生成S和CO2的能量变化如右图I所示,每生成16gS(s) ,该反应_______(填“放出”或“吸收”)的热量为_________。

(2)在绝热恒容的密闭容器中,进行反应:
2CO(g)+SO2(g) ![]() S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
A.若混合气体密度保持不变,则已达平衡状态
B.反应开始到平衡时,容器内气体的压强保持不变
C.达平衡后若再充人一定量CO2,平衡常数保持不变
D.分离出S,正、逆反应速率均保持不变
(3)向2L恒温恒容密闭容器中通入2molCO和lmolSO2,分别进行a、b、c三组实验。在不同条件下发生反应:2CO(g)+SO2(g)![]() S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。

Ⅱ.Na2SO3溶液吸收法
常温下,用300mL1.0mol·L-1,Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线如上图Ⅲ所示。
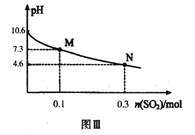
(4)1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________
(5)若用等体积、等物质的量浓度的下列溶液分别吸收SO2,则理论上吸收量最多的是____
A.NH3·H2O B.Na2S C.Na2CO3 D.FeCl3
(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在课外活动中,对某一份溶液成分(已知不含其他还原性离子)进行了检测,其中三次检测结果如下表所示:
检测序号 | 溶液中检测出的离子组合 |
第一次 | KCl、K2SO4、Na2CO3、NaCl |
第二次 | KCl、AlCl3、Na2SO4、K2CO3 |
第三次 | Na2SO4、KCl、K2CO3、NaCl |
下列说法合理的是( )
A. 三次检测结果都正确
B. 该溶液中的阳离子无法判断
C. 为了检验SO![]() ,应先加过量稀硝酸后再滴加Ba(NO3)2,观察是否有沉淀现象
,应先加过量稀硝酸后再滴加Ba(NO3)2,观察是否有沉淀现象
D. 为了确定是否存在CO![]() ,可以向其中滴加CaCl2溶液,观察是否有沉淀现象
,可以向其中滴加CaCl2溶液,观察是否有沉淀现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【衡水中学2017届第二次模拟】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
sabatior反应:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g) + O2(g)
2H2(g) + O2(g)
(1)将原料气按nCO2∶nH2=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
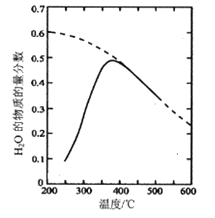
①己知H2(g)、CH4(g)的燃烧热分别为A kJ/mol、BkJ/mol, H2O(l)=H2O(g) △H =C kJ/mol。计算Sabatier反应的△H=___kJ/mol。
②温度过高或过低均不利于该反应的进行,原因是________。
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是______(填标号)。
A.适当减压 B.增大催化剂的比表面积
C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3) 一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
在250℃,向体积为2L且带气压计的恒容密闭容器中通入0.08molH2和0.04molCO2发生Bosch 反应CO2(g)+2H2(g)![]() C(s)+2H2O(g) △ H
C(s)+2H2O(g) △ H
①若反应起始和平衡时温度相同(均为250℃),测得反应过程中压强(P)随时间(t)的变化如图I 曲线a所示,则△H___ 0(填“>”“<”或“不确定”) ;若其它条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图I 曲线b所示,则改变的条件是______________。
②图II是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____________(填“甲”或“乙”):m值为____________。

③Bosch反应必须在高温下才能启动,原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列五组物质,其中一定互为同分异构体的组是( )
①淀粉和纤维素 ②硝基乙烷 C2H5NO2和甘氨酸NH2CH2COOH ③乙酸和乙二酸 ④二甲苯和苯乙烯 ⑤2-戊烯和环戊烷
A.①②B.②③④C.①③⑤D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,错误的是( )
A. 钠和冷水反应:2Na+2H2O═2Na++2OH﹣+H2↑
B. AlCl3溶液中加入足量的氨水:Al3++4OH﹣═AlO2﹣+2H2O
C. 将氯气通入水中:Cl2+H2O![]() Cl﹣+HClO+H+
Cl﹣+HClO+H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3﹣═3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是
A. FeCl2 B. AlCl3 C. FeCl3 D. CuCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com