
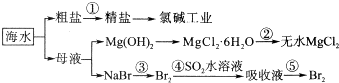
分析 海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子,可分别加热氯化钡、氢氧化钠、碳酸钠,过滤后加入盐酸,结晶得到精盐,可用于氯碱工业;母液中含有镁离子,加入氢氧化钠得到氢氧化镁,加入盐酸得到氯化镁晶体,在盐酸氛围中加热得到无水氯化镁;溴化钠中通入氯气得到溴,用二氧化硫吸收得到亚硫酸钠,继续通入氯气,得到溴,
(1)海水中的弱酸根离子水解显碱性;
(2)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答;
(3)氯化镁易水解,为防止水解过程③中结晶出的MgCl2•6H2O要一定条件下加热脱水制得无水MgCl2;
(4)电解饱和食盐水是电能转化为化学能,惰性电极电极熔融氯化镁生成氯气和金属镁,镁和水反应生成氢氧化镁和氢气;
(5)溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素;采用“空气吹出法”从浓海水中吹出Br2,并用SO2吸收利用二氧化硫还原性和溴单质反应生成硫酸和HBr.
解答 解:海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子,可分别加热氯化钡、氢氧化钠、碳酸钠,过滤后加入盐酸,结晶得到精盐,可用于氯碱工业;母液中含有镁离子,加入氢氧化钠得到氢氧化镁,加入盐酸得到氯化镁晶体,在盐酸氛围中加热得到无水氯化镁;溴化钠中通入氯气得到溴,用二氧化硫吸收得到亚硫酸钠,继续通入氯气,得到溴,
(1)海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、HCO3-等离子,在这些离子中能发生水解的是CO32-、HCO-3离子,HCO3-+H2O?H2CO3+OH-它们水解呈碱性,所以天然海水的pH≈8,呈弱碱性,
故答案为:HCO3-;
(2)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入适量盐酸除去反应剩余的氢氧根离子和碳酸根离子,故正确的顺序为:①②④⑤,
故答案为:①②④③;
(3)镁离子水解,应抑制其水解得到无水盐,所以利用MgCl2•6H2O制得无水氯化镁,应采取的措施是在HCl气流中脱水,抑制氯化镁水解,
故答案为:在HCl气流中脱水,抑制氯化镁水解,加热至恒重;
(4)电解原理分析,电解饱和食盐水是电能转化为化学能,采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,电解时,若有少量水存在会造成产品镁的消耗,发生反应为镁和水反应生成氢氧化镁和氢气,反应的化学方程式为:Mg+2H2O=Mg(OH)2↓+H2↑,
故答案为:电能;化学能;MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;Mg+2H2O=Mg(OH)2↓+H2↑;
(5)溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素,从第③步到第⑤步的目的是为了浓缩富集溴,采用“空气吹出法”从浓海水中吹出Br2,并用SO2吸收,溴单质和二氧化硫发生氧化还原反应生成硫酸和氢溴酸,发生反应的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBr,
故答案为:浓缩富集溴;Br2+SO2+2H2O=H2SO4+2HBr.
点评 本题考查物质的分离、提纯,为高考常见题型,侧重于学生的分析能力、实验能力的考查,题目涉及海水资源综合利用、离子的除杂、氧化还原反应、元素及其化合物的有关知识进行综合利用,提高了试题的综合性,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
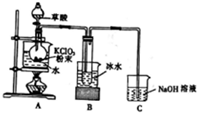 二氧化氯(ClO2)是一种高效消毒剂,在60℃时用氯酸钾与草酸(中强酸)反应可制备二氧化氯,实验装置如图所示.已知:通常情况下,二氧化氯的沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质确定的气体稀释,以防爆炸,回答下列问题:
二氧化氯(ClO2)是一种高效消毒剂,在60℃时用氯酸钾与草酸(中强酸)反应可制备二氧化氯,实验装置如图所示.已知:通常情况下,二氧化氯的沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质确定的气体稀释,以防爆炸,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
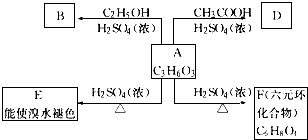
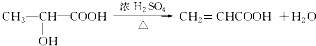 ;A→F
;A→F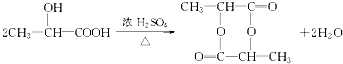
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
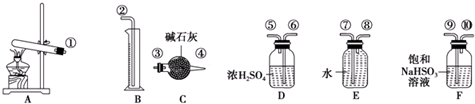
| 实验小组 | 称取CuSO4的质量/g | 装置C增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 2.56 | 224 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
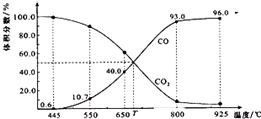 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(p分)=气体总压(p总)×体积分数.下列说法正确的是( )
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(p分)=气体总压(p总)×体积分数.下列说法正确的是( )| A. | 550℃时,若充入惰性气体,v正、v逆 均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡不移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.p总 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
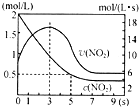 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: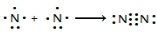 .
.| 化学键 | N-H | N-N | N═N | N≡N | O═O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5 g的氯化钠固体中含有NA个氯化钠分子 | |
| B. | 标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA | |
| C. | 0.1 mol•L-1氢氧化钠溶液中含钠离子数为0.1NA | |
| D. | 5.6 g铁与足量稀硫酸反应时失去电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
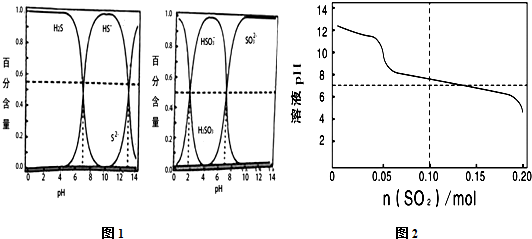
| A. | 由图1的一级电离与二级电离的Ka值可知H2SO3?2H++SO32- Ka≈10-7 | |
| B. | 向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,溶液中H2S、HS-、HSO3-、SO32-可同时一定量共存 | |
| C. | 向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,溶液中存在如下关系:c(H+)+c(Na+)═c(OH-)+2c(S2-)+2c(SO32-)+c(HS- )+c(HSO3-) | |
| D. | 在反应过程中当pH降至7.5左右,之后可能出现淡黄色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com