
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应的焓变为正值 |
| B、恒温下,增大压强,平衡正向移动 |
| C、升高温度,逆反应速率减小 |
| D、该反应化学方程式为CO+H2O=CO2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应的速率越大,化学反应的限度越大 |
| B、化学反应中既有物质变化,又有能量变化 |
| C、化学反应的实质是旧化学键断裂,新化学键形成 |
| D、可逆反应达到化学平衡状态,反应依然在进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
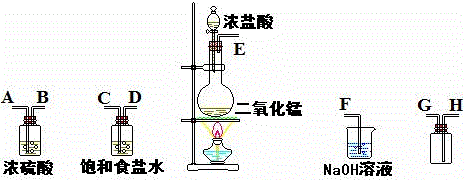
查看答案和解析>>
科目:高中化学 来源: 题型:
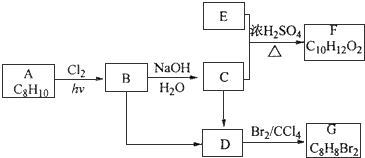
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2S溶液的水解:S2-+2H2O?H2S+2OH- | |||
| B、NaHCO3溶液的电离:HCO3-+H2O?CO32-+H3O+ | |||
| C、NH4Cl溶液的水解:NH4++H2O?NH3?H2O+H+ | |||
D、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
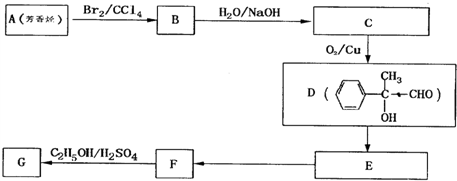
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸 |
| 蒸馏 |
| 一定条件 |
| 用标准溶液滴定 |
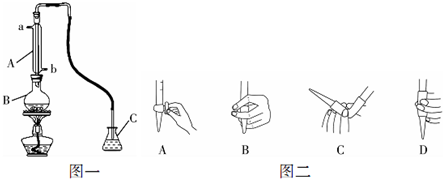
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com