
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
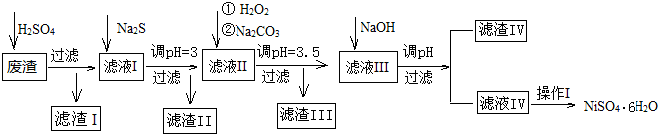
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
| pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单氢化物的热稳定性:Z>W | B. | 最高价氧化物的水化物的酸性:X<Z | ||
| C. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | D. | 沸点:XW2>Y2W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
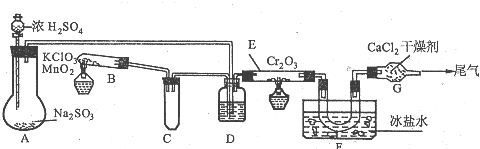
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=3的醋酸溶液中:c(H+)=c(CH3COO-)=3.0mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH-)=1×10-amol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | 常温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | N(B)/mol | N(D)/mol |
| T1 | 0.60 | - |
| T2 | - | 0.35 |
| A. | 上述信息可推知:T1<T2 | |
| B. | T1℃时,该反应的平衡常数K=$\frac{4}{9}$ | |
| C. | T2℃时,若反应达到平衡后再缩小容器的体积,c(C):c(D)不变 | |
| D. | T1℃时,若开始时反应物的用量均减小一半,平衡后A的转化率α(A)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com