
| A. | 洗净酸式滴定管后,立即装入标准盐酸进行滴定 | |
| B. | 锥形瓶用待测NaOH溶液润洗后,再装入NaOH 溶液进行滴定 | |
| C. | 操作过程中,滴定前平视读数,滴定后仰视读数 | |
| D. | 用酚酞作指示剂滴至红色刚退去,停止滴沄,立即读数 |
分析 根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A.洗净酸式滴定管后,立即装入标准盐酸进行滴定,酸式滴定管中含有蒸馏水,导致标准溶液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,测得结果偏大,故A错误;
B.锥形瓶用待测NaOH溶液润洗后,再装入NaOH 溶液进行滴定,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,测得结果偏大,故B错误;
C.操作过程中,滴定前平视读数,滴定后仰视读数,造成V(标准)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,测得结果偏大,故C错误;
D.用酚酞作指示剂滴至红色刚退去,停止滴沄,立即读数,未完全反应,造成V(标准)偏小,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,测得结果偏小,故D正确;
故选D.
点评 本题主要考查酸碱滴定实验的基本操作,侧重于学生的分析能力和实验能力的考查,难度不大,学生应注意操作的规范性和实验中常见的误差分析.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
| 1 | 分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①④溶液 | 略 |
| 2 | 向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 | ②中无明显现象 ③中红色明显变浅 | 滴加③时反应的化学方程式: C6H5OH+NaOH→C6H5ONa+H2O |
| 3 | 配制等物质的量浓度的CH3COONa、NaHCO3溶液,并比较其pH | NaHCO3溶液pH大于CH3COONa溶液 | 略 |
| 4 | 将CO2通入C6H5ONa溶液中 | 产生白色浑浊 | 反应的化学方程式:C6H5ONa+CO2+H2O=C6H5OH+NaHCO3 |
| 结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)④①③② | |||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
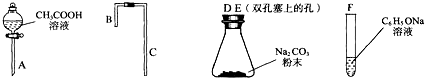
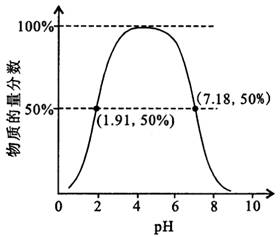
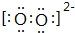 .
. 
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
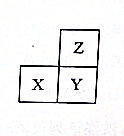
| A. | 最高正化合价:Z>X | |
| B. | X、Y、Z的单质中,Z的熔点最高 | |
| C. | 若X为非金属元素,则离子半径:Xn->Ym->Zm- | |
| D. | X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
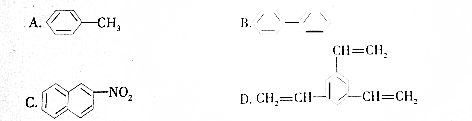
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1NaHCO3溶液:H+、Al3+、Cl-、CH3COO- | |
| B. | 0.1mol•L-1CuCl2溶液:K+、NH4+、OH-、S2- | |
| C. | 0.1mol•L-1FeCl2溶液:Na+、NH4+、I-、SO42- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液:Fe3+、Na+、SO32ˉ、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 金属离子 | PH值 | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
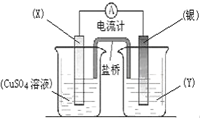 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com