
 ČēĶ¼ĖłŹ¾£¬¼×”¢ŅŅÖ®¼äµÄøō°åKæÉŅŌ×óÓŅŅĘ¶Æ£¬¼×ÖŠ³äČė2molAŗĶ1molB£¬ŅŅÖŠ³äČė2molCŗĶ1molHe£¬“ĖŹ±KĶ£ŌŚ0“¦£®ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśæÉÄę·“Ó¦£ŗ2A£Øg£©+B£Øg£©?2C£Øg£©£¬·“Ó¦“ļµ½Ę½ŗāŗ󣬻Öø“µ½·“Ó¦·¢ÉśĒ°Ź±µÄĪĀ¶Č£®ĻĀĮŠÓŠ¹ŲĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
ČēĶ¼ĖłŹ¾£¬¼×”¢ŅŅÖ®¼äµÄøō°åKæÉŅŌ×óÓŅŅĘ¶Æ£¬¼×ÖŠ³äČė2molAŗĶ1molB£¬ŅŅÖŠ³äČė2molCŗĶ1molHe£¬“ĖŹ±KĶ£ŌŚ0“¦£®ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśæÉÄę·“Ó¦£ŗ2A£Øg£©+B£Øg£©?2C£Øg£©£¬·“Ó¦“ļµ½Ę½ŗāŗ󣬻Öø“µ½·“Ó¦·¢ÉśĒ°Ź±µÄĪĀ¶Č£®ĻĀĮŠÓŠ¹ŲĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | øł¾Żøō°åK»¬¶ÆÓė·ńæÉÅŠ¶Ļ×óÓŅĮ½±ßµÄ·“Ó¦ŹĒ·ń“ļµ½Ę½ŗā | |
| B£® | “ļµ½Ę½ŗāŗó£¬øō°åK×īÖÕĶ£ĮōŌŚ×ó²ąæĢ¶Č0--2Ö®¼ä | |
| C£® | µ½“ļĘ½ŗāŹ±£¬¼×ČŻĘ÷ÖŠCµÄĪļÖŹµÄĮæ“óÓŚŅŅČŻĘ÷ÖŠCµÄĪļÖŹµÄĮæ | |
| D£® | ČōĘ½ŗāŹ±KĶ£ĮōŌŚ×ó²ą1“¦£¬Ōņ»īČūĶ£ĮōŌŚÓŅ²ą5--6Ö®¼ä |
·ÖĪö A£®Ę½ŗāŅĘ¶Æ£¬ĘųĢåĢå»ż»į·¢Éś±ä»Æ£¬øō°åĖęÖ®»¬¶Æ£»
B£®øł¾ŻæÉÄę·“Ó¦²»ÄÜĶźČ«·“Ó¦½ųŠŠ·ÖĪö£»
C£®ŅŅÖŠ³äČė1 mol He£¬µČÓŚøų¼×¼ÓŃ¹£¬Ę½ŗāÓŅŅĘ£¬BµÄĪļÖŹµÄĮæ¼õÉŁ£»
D£®”°øō°åK×īÖÕĶ£ĮōŌŚ×ó²ą1“¦”±ĖµĆ÷·“Ó¦ŗóĘųĢåĢå»żĪŖ5øń£¬¼“ĪļÖŹµÄĮæĪŖ2.5mol£¬ŅŅÖŠA”¢B”¢CČżÖÖĘųĢåµÄ×ÜĮæ±Č¼×ÖŠÖĮÉŁ¶ą1 mol£¬¼““óÓŚ3.5 mol£®
½ā“š ½ā£ŗA£®Ę½ŗāŅĘ¶Æ£¬ĘųĢåĢå»ż»į·¢Éś±ä»Æ£¬øō°åĖęÖ®»¬¶Æ£¬µ±øō°å²»ŅĘ¶ÆŹ±£¬ĖµĆ÷“ļµ½Ę½ŗāדĢ¬£¬¹ŹAÕżČ·£»
B”¢2A£Øg£©+B£Øg£©?2C£Øg£©£¬ÓÉÓŚ¼×ÖŠ³äČė2 mol AŗĶ1 mol B£¬·“Ó¦ĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬AÖŠŃ¹Ēæ½µµĶ£¬×ī¶ąÄÜ×Ŗ»ÆĪŖ2 mol C£¬µ«ŹĒÓÉÓŚ·“Ó¦ŹĒæÉÄę·“Ó¦£¬ĖłŅŌCµÄĪļÖŹµÄĮæŌŚ0-2 molÖ®¼ä£¬ĖłŅŌ“ļµ½Ę½ŗāŗó£¬øō°åK²»ŌŁ»¬¶Æ£¬×īÖÕĶ£ĮōŌŚ×ó²ąæĢ¶Č0-2Ö®¼ä£¬¹ŹBÕżČ·£»
C£®øō°åæÉŅŌ»¬¶Æ£¬ĖµĆ÷ŹĒµČŃ¹Ģõ¼ž£®ŅŅÖŠ³äČė1molHe£¬µČÓŚøų¼×¼ÓŃ¹£¬Ę½ŗāÓŅŅĘ£¬CµÄĪļÖŹµÄĮæŌö“ó£¬Ōņ¼×ČŻĘ÷ÖŠCµÄĪļÖŹµÄĮæ“óÓŚŅŅČŻĘ÷ÖŠCµÄĪļÖŹµÄĮ棬¹ŹCÕżČ·£»
D£®”°øō°åK×īÖÕĶ£ĮōŌŚ×ó²ą1“¦”±ĖµĆ÷·“Ó¦ŗóĘųĢåĢå»żĪŖ5øń£¬¼“ĪļÖŹĮæĪŖ2.5mol£¬¼×ÖŠĘųĢåµÄĪļÖŹµÄĮæĪŖ2.5 mol£¬ŅŅÖŠA”¢B”¢CČżÖÖĘųĢåµÄ×ÜĮæ±Č¼×ÖŠÖĮÉŁ¶ą1 mol£¬¼““óÓŚ3.5 mol£¬¹ŹŅŅÖŠĘųĢåµÄĢå»żŅŖŌŚ6æĢ¶ČÓŅ²ą£¬¹ŹD“ķĪó£»
¹ŹŃ”D£®
µćĘĄ ±¾Ģā½įŗĻŃ¹Ēæøıäæ¼²éĘ½ŗāµÄŅʶÆÖŖŹ¶”¢ÅŠ¶Ļµ½“ļĘ½ŗāµÄ±źÖ¾¼°µČŠ§Ę½ŗāµÄÓŠ¹ŲÖŖŹ¶£¬±¾Ģā×¢Ņā·ÖĪö·“Ó¦µÄæÉÄęŠŌĢŲÕ÷ŗĶĮ½ČŻĘ÷Ń¹ĒæĻąµČ£¬ÕāĮ½øö½Ē¶ČŹĒ½ā“šøĆĢāµÄ¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½«w g a%µÄNaClČÜŅŗÕō·¢µō$\frac{w}{2}$gĖ®£¬µĆµ½2a%µÄNaClČÜŅŗ | |
| B£® | ½«1Ģå»żc mol/LµÄĮņĖįÓĆĖ®Ļ”ŹĶĪŖ5Ģå»ż£¬Ļ”ČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ0.2c mol/L | |
| C£® | ½«5.85 g NaCl¾§ĢåČÜÓŚĖ®Åä³É1LČÜŅŗ£¬ÖʵĆ0.01 mol/LµÄNaClČÜŅŗ | |
| D£® | 1 mol•L-1 AlCl3ČÜŅŗÖŠCl-µÄĪļÖŹµÄĮæÅضČÓė3 mol•L-1NH4ClČÜŅŗÖŠCl-µÄĪļÖŹµÄĮæÅضČĻąµČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŗ¬ÓŠ“óĮæFe3+µÄČÜŅŗ£ŗNa+”¢SCN-”¢Cl-”¢I- | |
| B£® | ÖŠŠŌČÜŅŗ£ŗFe3+”¢Al3+”¢NO${\;}_{3}^{-}$”¢SO${\;}_{4}^{2-}$ | |
| C£® | ³£ĪĀĻĀ£¬pH=12µÄČÜŅŗ£ŗNa+”¢K+”¢Cl-”¢SO${\;}_{4}^{2-}$ | |
| D£® | ÓėĀĮ·Ū·“Ó¦·Å³öH2µÄĪŽÉ«ČÜŅŗ£ŗBr-”¢Al3+”¢Na+”¢SO${\;}_{4}^{2-}$ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
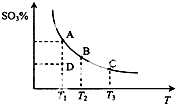 ¶žŃõ»ÆĮņµÄ“ß»ÆŃõ»ÆŌĄķĪŖ2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©£¬·“Ó¦»ģŗĻĢåĻµŌŚĘ½ŗāדĢ¬Ź±SO3µÄ°Ł·Öŗ¬ĮæÓėĪĀ¶ČµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©
¶žŃõ»ÆĮņµÄ“ß»ÆŃõ»ÆŌĄķĪŖ2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©£¬·“Ó¦»ģŗĻĢåĻµŌŚĘ½ŗāדĢ¬Ź±SO3µÄ°Ł·Öŗ¬ĮæÓėĪĀ¶ČµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©| A£® | ŌŚDµćŹ±vÕż£¾vÄę | |
| B£® | ĘäĖūĢõ¼ž²»±ä£¬Ōö“óŃõĘųµÄÅضČæÉŅŌĢįø߶žŃõ»ÆĮņµÄ×Ŗ»ÆĀŹ | |
| C£® | ČōB”¢CµćµÄĘ½ŗā³£Źż·Ö±šĪŖKB”¢KC£¬ŌņKB£¾KC | |
| D£® | ŗćĪĀŗćČŻĻĀĻņĘ½ŗāĢåĻµÖŠĶØČėŗ¤Ęų£¬Ę½ŗāĻņÓŅŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
 ·“Ó¦aM£Øg£©+bN£Øg£©?cP£Øg£©+dQ£Øg£©“ļµ½Ę½ŗāŹ±£¬MµÄĢå»ż·ÖŹży£ØM£©Óė·“Ó¦Ģõ¼žµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®ĘäÖŠz±ķŹ¾·“Ó¦æŖŹ¼Ź±NµÄĪļÖŹµÄĮæÓėMµÄĪļÖŹµÄĮæÖ®±Č£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
·“Ó¦aM£Øg£©+bN£Øg£©?cP£Øg£©+dQ£Øg£©“ļµ½Ę½ŗāŹ±£¬MµÄĢå»ż·ÖŹży£ØM£©Óė·“Ó¦Ģõ¼žµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®ĘäÖŠz±ķŹ¾·“Ó¦æŖŹ¼Ź±NµÄĪļÖŹµÄĮæÓėMµÄĪļÖŹµÄĮæÖ®±Č£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | Ķ¬ĪĀĶ¬Ń¹Ķ¬zŹ±£¬¼ÓČė“߻ƼĮ£¬Ę½ŗāŹ±QµÄĢå»ż·ÖŹż²»øıä | |
| B£® | Ķ¬ĪĀĶ¬Ń¹Ź±£¬Ōö¼Óz£¬Ę½ŗāŹ±QµÄĢå»ż·ÖŹżŅ»¶ØŌö¼Ó | |
| C£® | Ķ¬ĪĀĶ¬zŹ±£¬Ōö¼ÓŃ¹Ēæ£¬Ę½ŗāŹ±QµÄĢå»ż·ÖŹżŅ»¶Ø¼õŠ” | |
| D£® | Ķ¬Ń¹Ķ¬zŹ±£¬ÉżøßĪĀ¶Č£¬Ę½ŗāŹ±QµÄĢå»ż·ÖŹżŅ»¶ØŌö¼Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 3A+2B=2C | B£® | 2A+3B=2C | C£® | 3A+2B=3C | D£® | A+B=C |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| ČŻĘ÷±ąŗÅ | ĘšŹ¼Ź±ø÷ĪļÖŹĪļÖŹµÄĮæ/mol | Ę½ŗāŹ±·“Ó¦ÖŠµÄÄÜĮæ ±ä»Æ | ||
| N2 | H2 | NH3 | ||
| ¢Ł | 1 | 3 | 0 | ·Å³öČČĮæa kJ |
| ¢Ś | 0 | 0 | 2 | ĪüŹÕČČĮæb kJ |
| ¢Ū | 2 | 6 | 0 | ·Å³öČČĮæc kJ |
| A£® | ČČĮæ¹ŲĻµ£ŗa+b=92.4 | B£® | ČżøöČŻĘ÷ÄŚ·“Ó¦µÄĘ½ŗā³£Źż£ŗ¢Ū£¾¢Ł=¢Ś | ||
| C£® | Ę½ŗāŹ±°±ĘųµÄĢå»ż·ÖŹż£ŗ¢Ł=¢Ś£¾¢Ū | D£® | ¢ŁN2µÄ×Ŗ»ÆĀŹ+¢ŚNH3µÄ×Ŗ»ÆĀŹ=100% |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com