
分析 硫酸、氢氧化钠、HCl、碳酸钠、氢氧化钡都属于强电解质,在溶液中完全电离,电离方程式用等号,据此写出5种物质的电离方程式.
解答 解:(1)硫酸为强电解质,在溶液中完全电离,其电离方程式:H2SO4=2H++SO42-,
故答案为:H2SO4=2H++SO42-;
(2)NaOH是强电解质,在水溶液里完全电离生成钠离子、氢氧根离子,其电离方程式为:NaOH=Na++OH-,
故答案为:NaOH=Na++OH-;
(3)HCl为强电解质,在溶液中完全电离出氢离子和氯离子,其电离方程式为:HCl=H++Cl-,
故答案为:HCl=H++Cl-;
(4)碳酸钠为强电解质,在溶液中完全电离出钠离子和碳酸根离子,其电离方程式为:Na2CO3═2Na++CO32-,
故答案为:Na2CO3═2Na++CO32-;
(5)Ba (OH)为强电解质,完全电离,其电离方程式为:Ba(OH)2=Ba2++2OH-,
故答案为:Ba(OH)2=Ba2++2OH-.
点评 本题考查了电离方程式书写,题目难度不大,明确电离方程式的书写原则为解答关键,注意掌握强弱电解质的概念及判断方法,试题侧重基础知识的考查,有利于提高学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③ | C. | ①② | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若c=32(a+b),则b=2a | B. | 若c<32(a+b),则a>2b | ||
| C. | 若a<2b,则c=48a | D. | 若a>2b,则32(a+b)>c>96b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
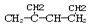 名称是1,3-二甲基-2-丁烯
名称是1,3-二甲基-2-丁烯| A. | 都不正确 | B. | ③⑤⑥正确 | C. | ②④⑥正确 | D. | ①③⑥正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+Br2+H2O═H2SO4+2HBr | B. | SO2+H2O═H2SO3 | ||
| C. | SO2+2NaOH═Na2SO3+H2O | D. | SO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 硫酸溶液/mL | 20.0 | 40.0 | 60.0 | 80.0 |
| 剩余固体/g | 9.36 | 7.12 | 4.88 | 3.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极 | B. | 电子从锌极流出 | ||
| C. | 锌极发生氧化反应 | D. | 电解液肯定不是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
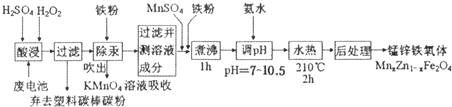
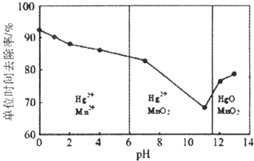
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com