
离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有 (填编号)。
①单质 ②氧化物 ③化合物 ④盐
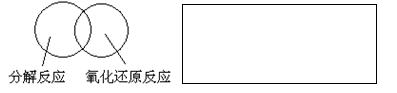
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
 (3)有一瓶澄清的溶液,其中可能含有H + 、NH + 4 、Mg 2+ 、Ba 2+ 、Al 3+ 、I - 、NO - 3 、CO 2- 3 、SO 2- 4 、AlO - 2 ,取该溶液进行以下实验:
(3)有一瓶澄清的溶液,其中可能含有H + 、NH + 4 、Mg 2+ 、Ba 2+ 、Al 3+ 、I - 、NO - 3 、CO 2- 3 、SO 2- 4 、AlO - 2 ,取该溶液进行以下实验:
①取pH试纸检验,表明溶液呈强酸性。排除_________离子存在。
②取出部分溶液,加入少量CCl 4 及数滴新制氯水,经振荡后CCl 4 呈紫红色,可以排除 存在。
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在反应过程中均无沉 淀产生,则可排除_________的存在。
淀产生,则可排除_________的存在。
④取部分上述碱性溶液加Na 2 CO 3  溶液,有白色沉淀生成,证明______存在,又排除________存在。
溶液,有白色沉淀生成,证明______存在,又排除________存在。
⑤根据上述实验事实还不能确定是否存在的离子是____ ____;
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述中正确的是( )
A. 已知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣802 kJ/mol,甲烷的燃烧热为802 kJ/mol
B. 等量H2在O2中完全燃烧,生成H2O(g)比生成H2O(l)放出的热量多
C. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
D. 由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
关于离子键、共价键的各种叙述中,下列说法中正确的是( )
|
| A. | 在离子化合物里,只存在离子键,没有共价键 |
|
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 |
|
| C. | 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
|
| D. | 由不同元素组成的含多个原子的分子里,一定只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对溶液中的离子反应,下列说法正确的是
①不可能是氧化还原反应 ②只能是复分解反应 ③可能是置换反应 ④不能没有分子参加
A.①③
B.③
C.①②
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原滴定与酸碱中和滴定一样是化学实验室常用的定量测定方法。某氧化还 原滴定的反应体系中有反应物和生成物共六种, 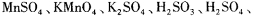
 ,其中H 2 SO 3 的还原性最强,KMnO 4 的氧化性最强。对此反应体系:
,其中H 2 SO 3 的还原性最强,KMnO 4 的氧化性最强。对此反应体系:
(1) 被氧化的元素是_______;发生还原反应的过程是________→______。
(2) 请用这六种物质组织一个合理的化学反应,写出它的离子方程式:_______
(3) 反应中H 2 SO 4 是_______ (填编号)
A,氧化剂 B.氧化产物 C.生成物 D.反应物
(4) 当有20mL 0.1mol/L的氧化剂参加反应时,电子转移数目是_______ 。
(5) 用标准KMnO 4 溶液滴定H 2 SO 3 时,滴定终点时颜色变化是_______。
(6) 滴定过程中.下列图像所表示的关系正确的是_______(填编号)。 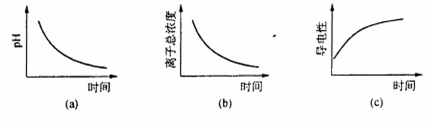
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向10 mL0.1 mol·L-1的HCl溶液中逐滴加入0.1 mol·L-1的NH3·H2O溶液,其pH逐渐增大,图中a、b、c三点的pH为实验所测得。下列有关说法中一定错误的是
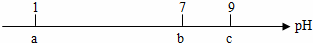
A.常温下,0.1 mol·L-1的HCl溶液的pH=1
B.当pH=7时,所加NH3·H2O溶液的体积大于10 mL
C.当7<pH<9时,溶液中c(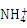 )>c(Cl-)
)>c(Cl-)
D.继续滴加0.1 mol·L-1的NH3·H2O溶液,溶液的pH最终可以变化至13
查看答案和解析>>
科目:高中化学 来源: 题型:
以硼镁矿(2Mg·B2O3·H2O·SiO2 )及少量Fe3O4、CaCO3、Al2O3 )为原料生产硼酸的工艺流程如下:
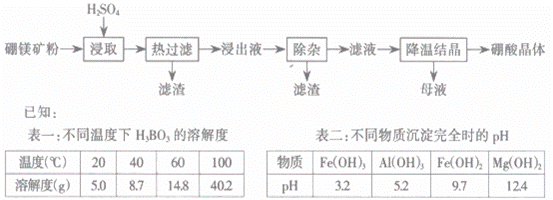
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为_____。
(2) “浸出液”显酸性,含有H3BO3、Mg2+和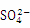 ,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量目H2O2和MgO,可以除去的杂质离子为_________,H2O2的作用为_________(用离子方程式表示)。
,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量目H2O2和MgO,可以除去的杂质离子为_________,H2O2的作用为_________(用离子方程式表示)。
(3) “浸取”后,采用“热过滤”的目的为_______。
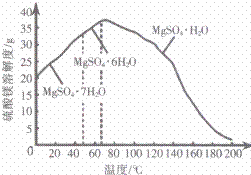
(4) “母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收 MgSO4·H2O,应采取的措施是将“母液”蒸发浓缩,____。
(5)已知25 ℃时,硼酸( H3BO3)溶液中存在如下平衡:
H3BO3(aq)+H2O(l)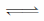 [B(OH)4]-(aq)+H+(aq) K=5.7×10-10;
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10;
25℃时,0.7 mol·L-1硼酸溶液中c(H+)≈mol·L-1。
(6)已知25 ℃时:
| 化学式 | H2CO3 | CH3COOH |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是_____________(填选项字母)。
A.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
C.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
D.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com