
| A. | K+、Cu2+、NO3-、CO32- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | Mg2+、NH4+、NO3-、CO32- | D. | NH4+、K+、OH-、SO42- |
科目:高中化学 来源: 题型:选择题
| A. | 由水电离产生的c(H+)=10-12 mol/L的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 在c(H+)=$\sqrt{{K}_{W}}$mol/L的溶液中:K+、Fe3+、HCO3-、AlO2- | |
| C. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、SO42-、Cl- | |
| D. | pH=13的溶液中:NH4+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
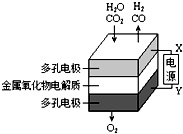 在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小、增大、减小 | B. | 增大、减小、减小 | C. | 减小、增大、增大 | D. | 增大、减小、增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO42-、NO3- | |
| B. | 将过量二氧化硫气体入冷氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 1.0mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 硫化铜溶于硝酸的离子方程式为CuS+2H+═H2S↑+Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2-酸性氧化物 Na2O2-碱性氧化物 Al2O3-两性氧化物 | |
| B. | 盐酸-混合物 胆矾-纯净物 C60-单质 | |
| C. | 纯碱-碱 硫化氢-酸 小苏打-酸式盐 | |
| D. | 液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
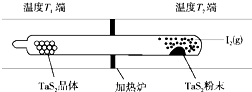 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com