
| A. | NH3+HCl═NH4Cl | B. | 4NH3+5O2$\frac{\underline{\;Pt\;}}{△}$4NO+6H2O | ||
| C. | 3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O | D. | 8NH3+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$6NH4Cl+N2 |
分析 还原性是指元素化合价上升,碱性是指能跟酸性物质反应.NH3中N的化合价为-3价,H的化合价为+1价,说明氨气具有还原性,只能是NH3中-3价的N化合价上升,说明氨气具有碱性,是指NH3能跟酸性物质反应
解答 解:A.NH3+HCl═NH4Cl,反应前后化合价未变,该反应不是氧化还原反应,不合题意,故A错误;
B.反应4NH3+5O2$\frac{\underline{\;Pt\;}}{△}$4NO+6H2O中氨气中氮元素化合价升高表现为还原性,无碱性表现,故B错误;
C.3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O中NH3-3价的N被CuO氧化,氧化产物为N2,N2化合价为0价,氨气具有还原性.不表现为碱性氧,故C错误;
D.8NH3+3Cl2═6NH4Cl+N2为化还原反应,NH3中-3价的N被Cl2氧化,氧化产物为N2,NH3跟酸性气体HCl物质反应,为非氧化还原反应显示了氨气的碱性,故D正确,
故选D.
点评 本题考查氧化还原反应、氨气的化学性质,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的相关性质,注重相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
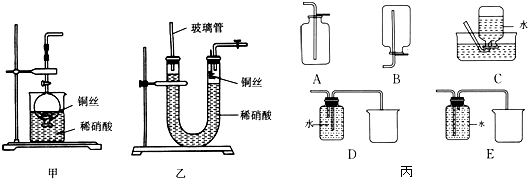
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结合H+的能力:Y>CO${\;}_{3}^{2-}$>X>HCO${\;}_{3}^{-}$ | |
| B. | 三种酸的电离常数Ki(HX)>Ki(HY)>Ki(H2CO3) | |
| C. | 溶液碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| D. | NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO${\;}_{3}^{-}$)>c (X)>c(OH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,浓H2SO4可以用铝(或铁)容器贮存,说明浓H2SO4与Al(或Fe)常温下不反应 | |
| B. | 在蔗糖中加入浓H2SO4后出现发黑现象,说明浓H2SO4具有脱水性 | |
| C. | 浓H2SO4能使胆矾由蓝变白,说明浓H2SO4具有吸水性 | |
| D. | 稀H2SO4能与Fe反应产生H2,说明稀H2SO4也有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba (OH)2溶液与过量NaHCO3溶液混合离子方程式:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| B. | Na+的结构示意图: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 氢氧化铁的电离方程式:Fe(OH)3═Fe3++3OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
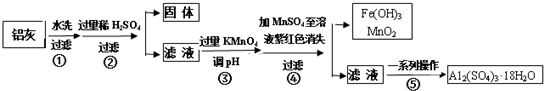
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| ① | 物质微粒数 | 阿伏加德罗常数 |
| ② | 标况下气体摩尔体积 | 标况下气体体积 |
| ③ | 溶剂的体积 | 溶质的物质的量浓度 |
| ④ | 溶液中溶质的质量分数 | 溶液的质量 |
| ⑤ | 非标况下物质的质量 | 物质的摩尔质量 |
| A. | ③ | B. | ③④ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com