
| A. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
分析 氧化还原反应的实质为电子转移、特征为化合价升降,所以氧化还原反应中一定存在元素化合价变化,据此对各选项进行判断..
解答 解:A.CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2反应中,C、H元素的化合价发生变化,属于氧化还原反应,故A正确;
B.CaCO3+H2O+CO2═Ca(HCO3)2为化合反应,没有元素的化合价发生变化,不属于氧化还原反应,故B错误;
C.CuO+2HCl═CuCl2+H2O反应中,不存在化合价变化,不属于氧化还原反应,故C错误;
D.NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑为分解反应,不存在化合价变化,不属于氧化还原反应,故D错误;
故选A.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握四种基本反应类型与氧化还原反应之间的关系,试题有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中醋酸根浓度与醋酸分了浓度比值变大 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液的导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
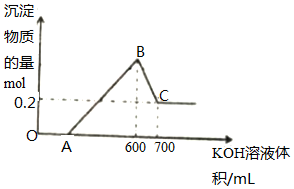 将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体.向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体.向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再充入等物质的量的CO2和H2达到新的平衡状态,CO的体积分数不变 | |
| B. | 再向容器中再充入1molCO,平衡正向移动,H2的体积分数增大 | |
| C. | 若起始时充入1.2mol H2O(g)和0.6mol CO,达到平衡时H2的体积分数不变 | |
| D. | 若起始时充入0.9mol H2O(g)、0.6mol CO、0.7mol CO2和0.8molH2,则此时υ正=υ逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 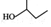 的名称为2-甲基-1-丙醇 的名称为2-甲基-1-丙醇 | B. | 氯乙烯和聚乙烯均能发生加成反应 | ||
| C. | C3H2Cl6 有4种同分异构体 | D. | C2H4和C4H8一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:W>Z>X | B. | 单质熔点:W>Z | ||
| C. | 最高正价:W>X>Y>Z | D. | 原子序数:Z>W>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 提取碘水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度比水中大 |
| B | 除去纯碱中的碳酸氢铵 | 加热 | 纯碱的热稳定性大于碳酸氢铵 |
| C | 分离KNO3和NaCl | 重结晶 | 硝酸钾的溶解度大于氯化钠 |
| D | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯密度大于乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
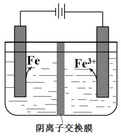
| A. | 阴极主要发生反应:Fe2++2e-═Fe | |
| B. | 向阳极附近滴加KSCN溶液,溶液变红 | |
| C. | 电解一段时间后,阴极附近pH减小 | |
| D. | 电解法制备高纯铁总反应:3Fe2+$\frac{\underline{\;电解\;}}{\;}$Fe+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
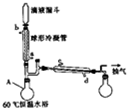 过氧乙酸常用作氧化剂和灭菌剂,实验室合成过氧乙酸并测定其含量的相关步骤如下:
过氧乙酸常用作氧化剂和灭菌剂,实验室合成过氧乙酸并测定其含量的相关步骤如下: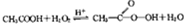
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com