
| A. | 强电解质溶液一定比弱电解质溶液的导电性强 | |
| B. | 强电解质的水溶液中不存在分子 | |
| C. | 进行中和滴定时,锥形瓶不能用所盛溶液润洗 | |
| D. | 不同的弱电解质只要物质的量浓度相同,电离程度也相同 |
分析 A.溶液导电能力取决于溶液中离子浓度大小,与电解质强弱无关;
B.强电解质完全电离成离子,但溶液中存在溶剂水分子;
C.中和滴定中,锥形瓶不能润洗,否则影响测定结果;
D.不同弱电解质电离程度不一定相同.
解答 解:A.溶液导电能力取决于溶液中离子浓度大小,强电解质溶液的导电性不一定比弱电解质溶液的导电性强,故A错误;
B.强电解质的特征是水溶液中完全电离,但是溶液中存在水分子,故B错误;
C.锥形瓶不能润洗,否则会导致待测液中溶质的物质的量偏大,影响测定结果,故C正确;
D.不同弱电解质电离程度由本性决定,浓度相同的弱电解质在溶液中电离程度不一定相同,故D错误;
故选C.
点评 本题考查了弱电解质的电离及其影响,题目难度中等,涉及强弱电解质的判断、溶液导电性强弱判断、中和滴定操作方法等知识,注意掌握弱电解质的概念、电离平衡及其影响因素,明确中和滴定中锥形瓶的使用方法.


科目:高中化学 来源: 题型:选择题
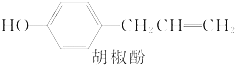
| A. | 该化合物属于芳香烃 | |
| B. | 该化合物的分子式是 C9H11O | |
| C. | 分子中所有碳原子一定处于同一平面 | |
| D. | 1 mol该化合物最多可与4 mol H2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.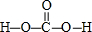 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质溶液加入饱和(NH4)2SO4溶液,蛋白质析出,再加入水不溶解 | |
| B. | 人工合成的具有生命活性的蛋白质---结晶牛胰岛素,是我国科学家在世界上第一次合成的 | |
| C. | 蚕丝、动物毛发、皮革制品等生活常见物品主要成分均为蛋白质 | |
| D. | 浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,向含AgCl固体的AgCl溶液中加入NaCl固体,AgCl沉淀的量不变 | |
| B. | 滴定终点时,溶液中CrO42-的浓度约为3.6×10-3 mol•L-1 | |
| C. | 向0.1moL/L AgNO3溶液中滴加3-5滴0.1moL/L NaCl溶液生成AgCl沉淀,再滴加KI溶液,生成AgI沉淀,能够说明Ksp(AgI)<Ksp(AgCl) | |
| D. | 可用0.1 mol•L-1的KI溶液代替K2CrO4做指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态原子含有未成对电子最多的第二周期元素 | |
| B. | 基态原子电子排布式为[Ne]3s23p1的元素 | |
| C. | 基态原子最外电子层排布为2s22p6的元素 | |
| D. | 基态原子最外电子层排布为3s23p5的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀溶液中:H++OH-═H2O;△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ | |
| B. | 由4P(s,红磷)═P4(s,白磷):△H>0可知,白磷的热稳定性比红磷大 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ•mol-1,则H2的燃烧热等于241.8 kJ•mol-1 | |
| D. | 己知:S(g)+O2(g)═SO2(g);△H1及S(s)+O2(g)═SO2(g):△H2,则△H1<△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com