
����Ŀ������6mol KI��������Һ����μ���KBrO3��Һ�����������к������ʵ����ʵ�����������KBrO3�����ʵ����Ĺ�ϵ��ͼ1��ʾ����֪ 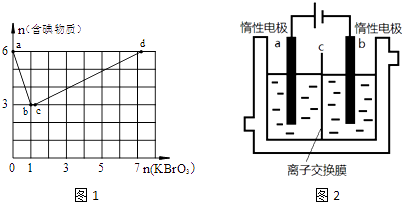
��BrO3��+6Iһ+6H+=3I2+Br��+3H2O��
��2BrO3��+I2=2IO3��+Br2��
��ش��������⣺
��1��b��ʱ��KI��Ӧ��ȫ�������ĵ��������뻹ԭ�����ʵ���֮��Ϊ �� ��ԭ������ ��
��2��b��c������ֻ��һ��Ԫ�صĻ��ϼ۷����仯��д���ù��̵����ӷ�Ӧ����ʽ ��
��3���ɷ�Ӧ����ͬѧ�ɴ˵ó������ԣ�I2��Br2�Ľ��ۣ�����Ϊ�Ƿ���ȷ����˵������ ��
��4����6mol KI��������Һ��������n��KBrO3�������ֵΪ ��
��5���ӵ�ʳ���к��е���أ�KIO3�������Ե�ⷨ�Ʊ�����أ�ʵ��װ����ͼ2��ʾ���Ƚ�һ�����ĵ����ڹ�������������Һ��������Ӧ��3I2+6KOH=5KI+KIO3+3H2O��������Һ��������������������������Һ��������������ʼ��⣮�����ĵ缫��ӦʽΪ�������۲쵽�������� ��
���𰸡�
��1��1��6��KBr
��2��BrO3��+5Br��+6H+=3Br2+3H2O
��3������ȷ���÷�Ӧ��I2����ԭ����Br2Ϊ��ԭ���Ӧ�ó���ԭ��I2��Br2����
��4��7.2
��5��I��+6OH����6e��=IO3��+3H2O�������ݲ�����
���������⣺��1��b��ʱ��KI��Ӧ��ȫ����ͼ���֪�μӷ�Ӧ��KIΪ6mol��KBrO3Ϊ1mol�������ĵ��������뻹ԭ�����ʵ���֮��Ϊ1��6��������ӦΪ6I��+BrO3��=Br��+3I2 �� ��ԭ������KBr�����Դ��ǣ�1��6��KBr����2��b��c�����У�����һ��Ԫ�ط������ϼ۱仯��Ӧ��BrO3����Br��֮���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪBrO3��+5Br��+6H+=3Br2+3H2O��
���Դ��ǣ�BrO3��+5Br��+6H+=3Br2+3H2O����3�����ݷ�Ӧ��2BrO3��+I2�T2IO3��+Br2 �� ��ԭ���Ļ�ԭ��ǿ�ڻ�ԭ����������ԣ����Եó���ԭ��I2��Br2 �� ���Դ��ǣ�����ȷ���÷�Ӧ��I2����ԭ����Br2Ϊ��ԭ���Ӧ�ó���ԭ��I2��Br2���ۣ���4�������ķ�Ӧ������6I��+6H++BrO3��=Br��+3I2+3H2O��BrO3��+5Br��+6H+=3Br2+3H2O��2BrO3��+I2=2IO3��+Br2 �� �ܷ�ӦΪ5I��+6H++6BrO3��=5IO3��+3Br2+3H2O����6molKI��������Һ��������n��KBrO3�������ֵΪ1.2��6mol=7.2mol�����Դ��ǣ�7.2����5�������������������е����ӡ���������Ӻ����������ӣ��������������ϵ�����ʧ��������IO3�� �� �缫����ʽΪI��+6OH����6e��=IO3��+3H2O�������������ӷŵ����������������������������ݲ��������Դ��ǣ�I��+6OH����6e��=IO3��+3H2O�������ݲ�����


 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A���ڳ��³�ѹ�£�11.2LN2�����еķ�����Ϊ0.5NA
B���ڱ�״����, 22.4 L CO��N2�Ļ��������ʵ���Ϊ1mol
C���ڱ�״����, 18g H2O�����Ϊ22.4 L
D��1mol SO2�����Ϊ22.4 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2�ĺ����ǿ��������ձ���һ����Ҫ���ָ�꣬������ѧ֪ʶ�ش��������⣮
��1����ҵ����������У�SO2��������ԭ��Ϊ�� 2SO2��g��+O2��g�� ![]() 2SO3��g��
2SO3��g��
T��ʱ����ij�ܱ������г���һ��SO2��g����O2��g��������������Ӧ�����SO2��g����ƽ��ת���ʣ�a������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ1��ʾ��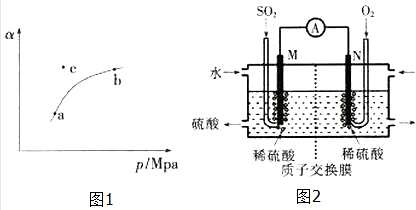
��a��b�����Ӧ��ƽ�ⳣ��K��a��K��b�������������������=������ͬ����SO2Ũ��c��a��c��b����
��c��ʱ����Ӧ����v������v���棩 ��
��2���绯ѧ������SO2 �� ���Ṥҵβ���е�SO2������������Ʊ����ᣬͬʱ��õ��ܣ�װ����ͼ2��ʾ���缫��Ϊ���Բ��ϣ���
��M�������ĵ缫��ӦʽΪ ��
����ʹ��װ�õĵ���ǿ�ȴﵽ2.0A��������ÿ����Ӧ��ͨ���״������������ΪL����֪��1��e����������Ϊ1.6��10��19C����
��3����Һ������SO2 �� ��֪������H2SO3��H2CO3�ĵ��볣�������ʾ��
���볣�� | K1 | K2 |
H2SO3 | 1.3��10��2 | 6.3��10��8 |
H2CO3 | 4.2��10��7 | 5.6��10��11 |
�����£���SO2����ͨ��100mL 0.2molL��1��Na2CO3��Һ�У���ͨ��448mLSO2ʱ��������Ϊ��״���µ��������ͬ�������������ӷ���ʽΪ����ͨ��896mLSO2ʱ��������Һ�������ԣ���Һ�и�����Ũ���ɴ�С��˳��Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������������ȷ����
ѡ�� | ʵ�� | ���� |
A | ���ȷ��������е�С���� | �����ۻ��ɹ�����С��ȼ��ʱ������Ϊ��ɫ��ȼ�պ����ɵ���ɫ���� |
B | �ھƾ����ϼ������� | �����ۻ���ʧȥ�����ۻ������������䣬������һ��Ĥ���� |
C | ��ȼ��þ������ʢ��O2�ļ���ƿ(�ײ���������ϸɳ)�� | þ������ȼ�գ�����ҫ�۰�ų��������������ɰ�ɫ���� |
D | �ڿ����о��õ���������NaOH��Һ�� | ���̲���������ɫ���ݣ�������ϸ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������������Al����NH4��2SO4��MgCl2��FeCl2��AlCl3�е����ֻ������ɣ��ֶԸû����������ʵ�飬����������й�������ͼ��ʾ��������������ѻ���ɱ�״���µ�����������ڸù����������˵����ȷ���ǣ� �� 
A.һ������Al��������Ϊ4.5g
B.һ������FeCl2 �� ���ܺ���MgCl2��AlCl3
C.һ������MgCl2��FeCl2
D.һ�����У�NH4��2SO4��MgCl2 �� �����ʵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������з�Ӧ�У� HCl �������������� ��
A. NaOH+HCl��NaCl+H2O
B. Zn+2HCl=ZnCl2+H2��
C. MnO2+4HCl(Ũ)![]() MnCl2+2H2O+Cl2��
MnCl2+2H2O+Cl2��
D. CuO+2HCl=CuCl2+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ơ��������ơ�̼���ƾ��ܷ�Ӧ���ǣ�
A. CH3CH2OHB. ��C. ��ϩD. CH3COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������װ�ý�һ������CO2��CO�Ļ��������з�����(ͼ�е�a��b��Ϊ���Կ��������ͨ����Һ��ļ����ֹˮ�кͻ�����ʵ��ǰ���ѹرգ������Ĺ̶�װ����ʡ��)����ѡ�����˵��Լ����������ʵ�顣�ɹ�ѡ����Լ��У�Ũ���ᡢϡ���ᡢŨ���ᡢϡ���ᡢ����ʯ��ˮ������������Һ����ɫʯ����Һ��
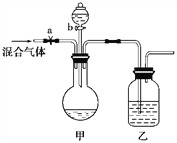
��1����װ�õ�ƿ��ʢ�ŵ��Լ���______________����Һ©����ʢ�ŵ��Լ���_____����װ�õ�ƿ��ʢ�ŵ��Լ���______________��
��2����aʱ�����ȷ������������________(������)��Ҫ�õ���һ�����壬��ȷ�IJ�����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�������е�һ����Ҫ��Ӧ��SO2�Ĵ�������2SO2��O22SO3������Ӧ���ȣ��������й�˵����ȷ����
A. �����¶�ֻ����淴Ӧ����
B. �����¶ȿ��������Ӧ����
C. ʹ�ô�������������Ӧ����
D. �ﵽ��ѧƽ��ʱ�����淴Ӧ��������ҵ���0
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com